研究標題:結合亞區域放射組學與多通道二維或三維深度學習模型預測局部晚期食管鱗狀細胞癌(LA-ESCC)患者對新輔助化療免疫治療(NACI)的反應

借鑒點:建模思路(看流程圖理解就夠了)
引言
? ? 食管癌是全球第七大常見惡性腫瘤和第六大癌癥相關死亡原因,構成重大健康挑戰。約一半病例在中國發現,主要為食管鱗狀細胞癌(ESCC)。約一半病例在中國發現,主要為食管鱗狀細胞癌。對于局部晚期食管鱗狀細胞癌(LA-ESCC)患者,新輔助免疫治療與化療相結合顯示出良好的治療效果。然而,新輔助化療免疫治療(NACI)方案的益處僅限于部分患者。因此,迫切需要可靠的、非侵入性的生物標志物來預測治療效果。影像組學是一種新興的非侵入性技術,通過從醫學圖像中提取定量特征,為腫瘤生物學提供有價值的見解。而深度學習憑借強大的自動特征提取能力,能夠從原始影像中挖掘復雜的空間關聯并提取高維語義信息,對模型準確性和泛化能力的提升效果顯著。因此,整合影像組學與深度學習構建療效預測模型,有望為食管鱗狀細胞癌患者提供更準確的新輔助化療反應預測工具,推動精準醫療的進步。
數據
該研究納入三個醫院的271名患者進行分析。其中,醫院A的230例患者按照7:3比例隨機劃分為訓練隊列及內部驗證隊列,醫院B和醫院C的41例患者作為外部驗證隊列。
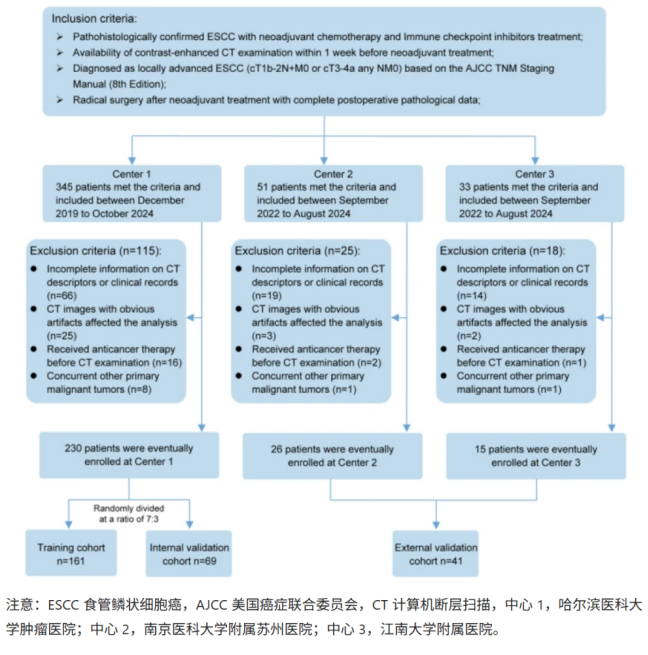
研究框架
Step1:生境區域劃分
基于勾畫的ROI區域,利用PyRadiomics從每個體素(1x1x1)中提取19個的放射組學特征。采用K-means聚類算法對腫瘤區域進行子區域劃分,具體而言,基于這些特征探索了 2 到 9 個聚類數量,Calinski–Harabasz 分數確定了最佳聚類數量,從而將腫瘤區域分割成多個亞區域。
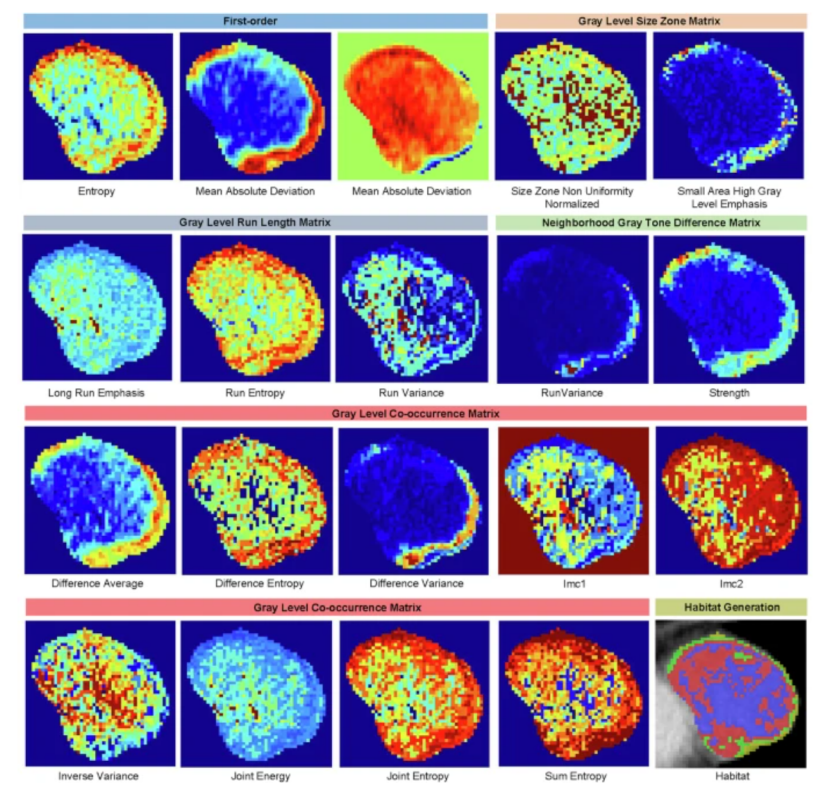 注:特征熱圖表示的是每個特征在每個體素上的值分布, 展示圖應該為腫瘤最大截面
注:特征熱圖表示的是每個特征在每個體素上的值分布, 展示圖應該為腫瘤最大截面
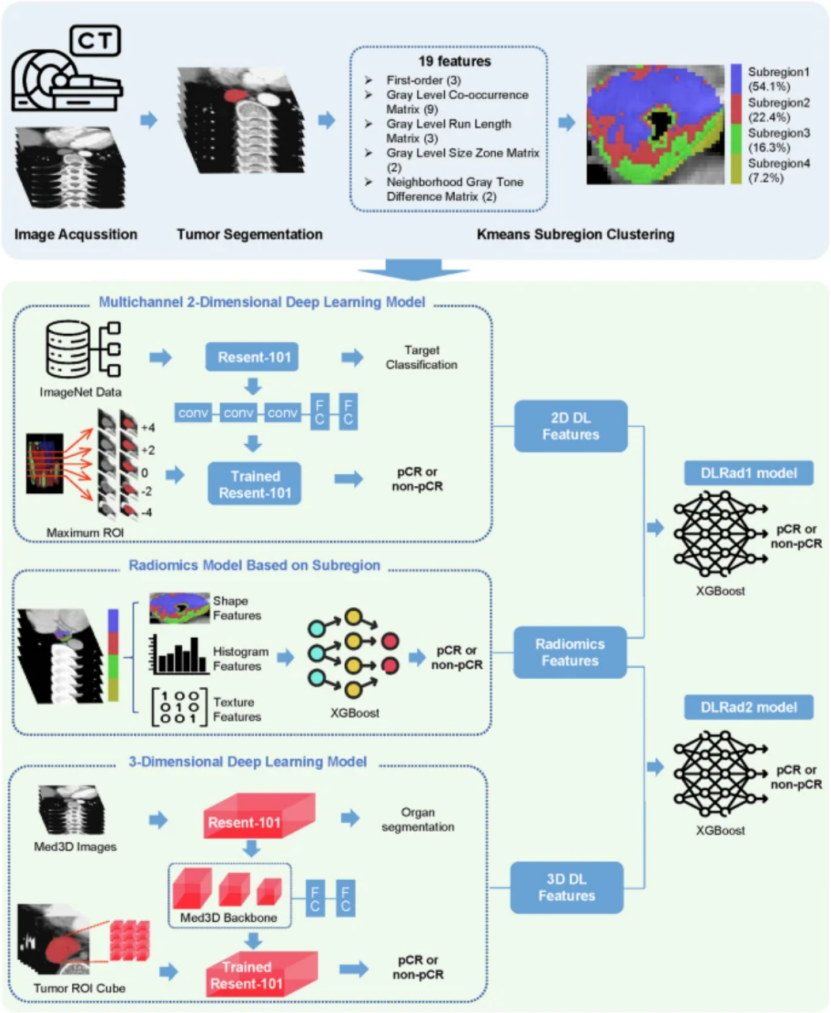
Step2:特征提取
傳統影像組學特征提取:基于PyRadiomics,采用8種圖像濾波器,對每個生境區域提取了1834項特征。
2D DL特征提取:利用預訓練的ResNet101網絡從多通道2D CT圖像(包括腫瘤最大橫截面及其上下五層切片,以捕捉腫瘤的空間上下文信息。)中提取2048個多通道二維特征。(圖像處理:線性插值將圖像裁剪并調整大小為統一的 256 × 256 像素尺寸。采用隨機水平翻轉、隨機垂直翻轉以及裁剪至 224 × 224 像素等數據增強方法來擴充數據集并增強模型魯棒性。最終輸入圖像尺寸標準化為 224 × 224 像素。)
3D DL特征提取:使用預訓練的3D ResNet101框架從腫瘤的3D立方體區域中提取2048個三維深度學習特征,以提取腫瘤的立體結構信息。(圖像處理:ROI 立方體被線性插值到 96×96×96 體素的大小)
Step3:特征選擇
Z 分數標準化對所有特征進行標準化處理,?Spearman相關性分析去除相關系數≥0.9的特征,組內相關系數(ICC)過濾去除冗余和不穩定特征(觀察者內和觀察者間 ICC<=0.75),Lasso分析選擇出對pCR預測最具信息量的關鍵特征。
Step4:模型構建
將亞區域1放射組學特征與深度學習特征進行融合形成聯合特征向量,使用 XGBoost 算法分別構建基于特征的融合模型。兩種融合模型如下:DLRad1,結合了基于亞區域1的影像組學特征和多通道 2D 深度學習特征;DLRad2,結合了亞區域1的影像組學特征與 3D 深度學習特征。
研究結局
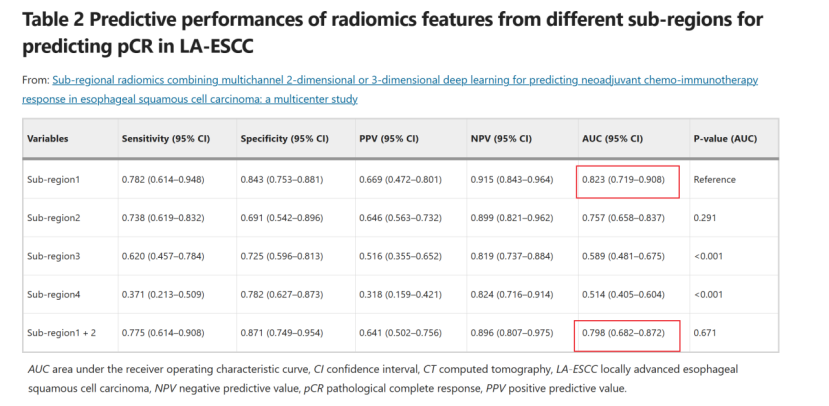
生境區域劃分及代表性生境區域選擇
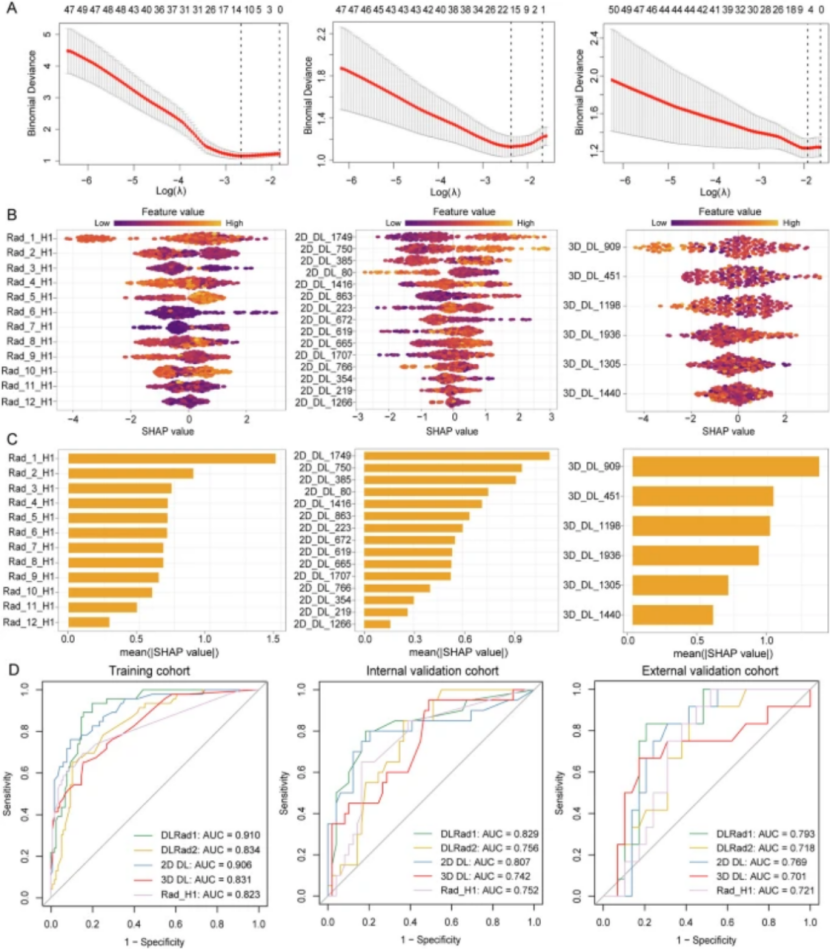
? ? 對于19個像素級特征,采用kmeans聚類進行亞區域劃分。Calinski-Harabasz指數確定最佳聚類數為4,表明腫瘤區域被分割成四個亞區域。且亞區域2、3、4的預測性能顯著低于亞區域1,亞區域1與亞區域2的組合并未提高診斷性能(P = 0.671)。因此,下續分析中僅將亞區域1的傳統放射組學特征與深度學習特征進行聯合建模。
特征選擇與模型構建
? ? 經過Spearman相關性和ICC過濾后,lasso進行最終特征選擇。最終,亞區域1放射組學特征選擇了12個關鍵特征,2D DL特征保留了15個關鍵特征,3D DL特征保留了6個關鍵特征。
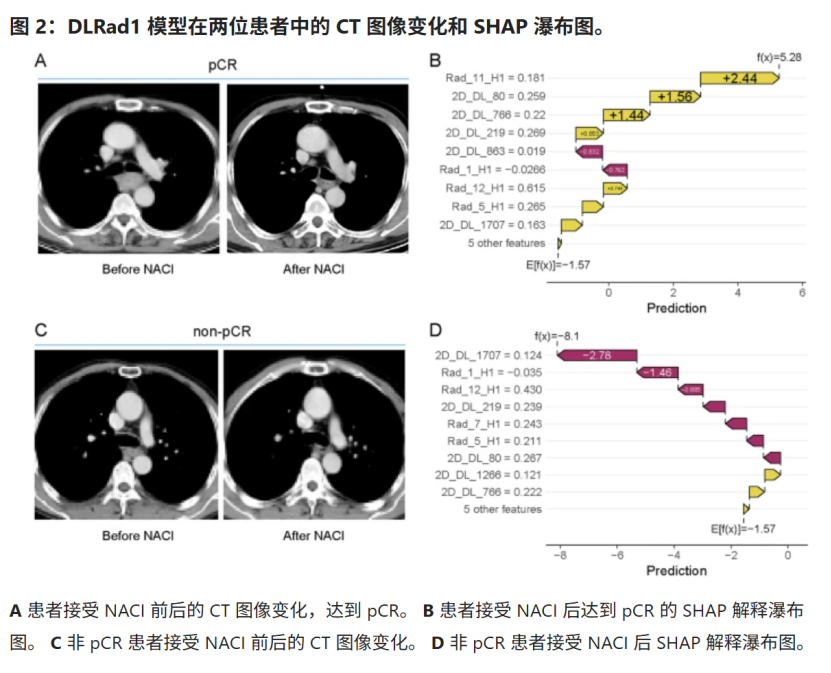
? ? ?分別基于亞區域1放射組學特征+2D DL特征、放射組學+3D DL進行建模。DLRad1模型的AUC(訓練集0.910,內部驗證集0.829,外部驗證集0.793)高于DLRad2,校準曲線在不同概率區間表現出強一致性,且具有更高的凈收益。SHAP 瀑布圖進一步可視化了單個特征在預測 pCR和非 pCR中的貢獻(圖2)。
臨床模型開發與模型比較
為探究影像組學特征是否能在常規臨床參數之外提升預測性能,單變量和多變量邏輯回歸分析用于識別與病理完全緩解(pCR)獨立相關的臨床因素。腫瘤長度成為唯一的顯著臨床預測因子(優勢比[OR] = 0.549,95%置信區間[CI]:0.180–0.915,P = 0.045)。隨后,本研究開發了一個結合臨床模型和 DLRad1 特征的組合模型,以評估影像組學特征的附加預測價值。訓練隊列中,聯合模型達到了最高的 AUC(0.919,95% CI:0.885–0.962),優于臨床模型(AUC=0.617,95% CI:0.536–0.698)和 DLRad1 模型(AUC=0.910,95% CI:0.867–0.954)。IDI 和 NRI 分析均顯示,在臨床模型中添加 DLRad1 時,判別力和分類能力均有統計學顯著提升(IDI=0.095 [0.038–0.151],P<0.001;NRI=0.317 [0.156–0.472],P<0.001)。
參考文獻:ZHU J, XU B, FAN T, 等. Sub-regional radiomics combining multichannel 2-dimensional or 3-dimensional deep learning for predicting neoadjuvant chemo-immunotherapy response in esophageal squamous cell carcinoma: a multicenter study[J/OL]. npj Precision Oncology, 2025, 9(1)[2025-07-26].?




)





)


)


![[自動化Adapt] 錄制引擎 | iframe 穿透 | NTP | AIOSQLite | 數據分片](http://pic.xiahunao.cn/[自動化Adapt] 錄制引擎 | iframe 穿透 | NTP | AIOSQLite | 數據分片)


