Characterization and structure-based protein engineering of a regiospecific saponin acetyltransferase from Astragalus membranaceus
表征和基于結構的蛋白質工程:黃芪特異性皂苷乙酰轉移酶,一篇乙酰基轉移酶文章精讀分享~

摘要
乙酰化有助于許多具有藥用重要性的天然產品的生物活性。然而,關于糖部分的乙酰化知之甚少。在這里,我們報道了來自黃芪的一種皂苷乙酰轉移酶AmAT7-3。通過逐步的基因挖掘方法發現AmAT7-3,該酶被鑒定為黃芪皂苷IV(1)的木糖C3′/C4′-O-乙酰轉移酶。為了闡明其催化機制,我們獲得了AmAT7-3/1和AmAT7-3A310G/1的復合晶體結構,揭示了一個由特定序列AADAG決定的大型活性口袋。結合量子力學/分子力學(QM/MM)計算,AmAT7-3的區域特異性是由周圍氨基酸(包括#A310和#L290)調節的糖定位決定的。此外,使用半理性設計構建了一個小型突變體庫,其中變體A310G和A310W分別被發現能催化特定的C3′-O和C4′-O乙酰化。AmAT7-3及其變體也被用來乙酰化其他生物活性皂苷。這項工作擴展了對皂苷乙酰轉移酶的理解,并為皂苷乙酰化提供了高效的催化工具。
引言
皂苷是一類分布廣泛且結構復雜的天然產物,具有多種生物活性。乙酰化是皂苷最常見的修飾方式之一,對提高其生物活性起著重要作用。例如,來自皂皮樹的乙酰化皂苷QS-7(在皂苷C-4上乙酰化)是一種受青睞的抗癌和抗病毒疫苗佐劑候選物,其在小鼠中的毒性幾乎可以忽略不計。人參皂甙-Rs4(在葡萄糖C-6上乙酰化)與未乙酰化的人參皂甙-Rg5相比,顯著誘導了SK-HEP-1細胞死亡。在齊墩果酸3-O-阿拉伯吡喃糖苷(C-3和C-4)上的乙酰化使得對A431細胞的細胞毒性提高了至少10倍。盡管全-O-化學酰化策略得到了高度發展,但由于羥基組的相對活性接近,糖部分的位點選擇性乙酰化具有挑戰性。以前的嘗試主要集中在保護變旋異構基團上,而皂苷分子上的乙酰化仍然很少見。在QS-7的化學合成中,構建乙酰化的皂苷殘基至少需要四個步驟,即C3-OH烷基化、C2-OH硅烷化、乙酰化和C3醚的去除,產率為47%。因此,使用化學催化劑合成多樣化的天然發生的乙酰化皂苷具有挑戰性。
皂苷的乙酰化很可能是由酰基轉移酶催化的,特別是糖苷乙酰轉移酶(ATs)。在這一組中功能鑒定的酶大多利用芳香酰或丙二酰基團作為供體。迄今為止,只有六種針對糖苷的乙酰轉移酶被報道,其中四種催化黃酮糖苷C6′-OH(Vh3MAT1、Lp3MAT1和CcAT1/2)和兩種修改三萜皂苷C4′-OH(QsACT1和SOAP10)。然而,由于酰基轉移酶的快速分化,上述酶在我們的分析中或在以前的報告中顯示出高度多樣性。例如,皂苷ATs QsACT1和SOAP10的序列相似性僅為20.7%。另一方面,盡管已經報道了七個酰基轉移酶的晶體結構,但其中沒有一個屬于能容納更大尺寸的皂苷的糖苷ATs。關于糖苷ATs的催化機制和區域特異性知之甚少。因此,發現催化皂苷乙酰化的ATs并揭示其催化機制具有挑戰性。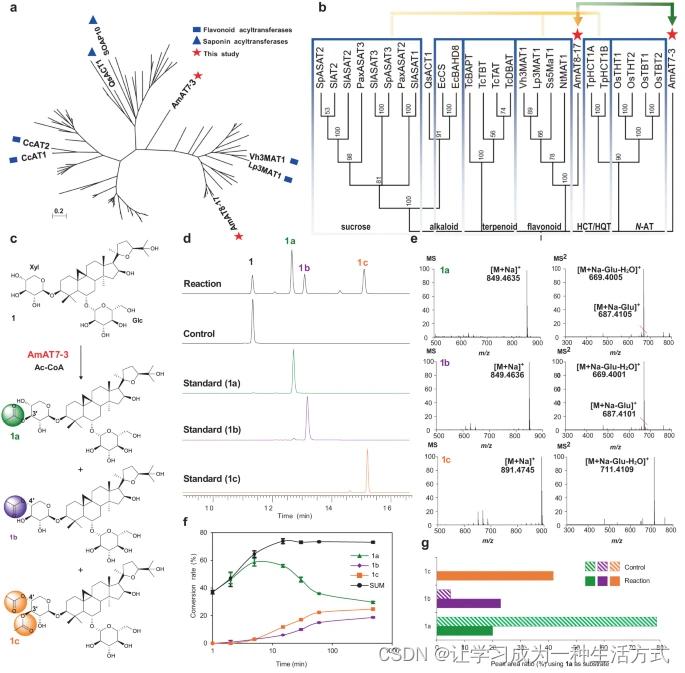
a 最大似然法構建的具有多種功能的乙酰轉移酶樹(補充數據1)。b 代表性酰基轉移酶與AmAT7-3的最大似然樹。在MEGA7中使用1000次自舉重復進行了進化分析。黃色和綠色箭頭分別指示第一輪和第二輪基因篩選。HCT/HQT,代表了香草酸或奎寧酸酰基轉移酶。c AmAT7-3催化的黃芪皂苷IV(1)的乙酰化。d UPLC/MS反應、對照和標準樣品的總離子流色譜圖。e 產物1a、1b、1c的HR-MS和HR-MS/MS分析,正離子模式。f 使用1作為底物的AmAT7-3酶促反應的時間進程。數據以平均值±標準差呈現(n = 2或3次獨立實驗)。源數據提供為源數據文件。g 在使用1a作為底物的AmAT7-3反應混合物中,1a-1c的峰面積比。Glc表示葡萄糖基團;Xyl表示木糖基團;Ac-CoA表示乙酰輔酶A;反應:由AmAT7-3催化的乙酰化反應;對照:反應混合物中使用了煮沸的AmAT7-3。
黃芪皂苷是黃芪根的主要生物活性成分,黃芪根是一種源自黃芪(Astragalus membranaceus)的全球流行的草藥。黃芪皂苷具有環烷烷型骨架,在其C3-木糖基團上進行多種乙酰化修飾,生成的化合物包括黃芪皂苷II(1d,C2′-O-Ac)、異黃芪皂苷II(1a,C3′-O-Ac)、環首皂苷II(1b,C4′-O-Ac)、黃芪皂苷I(1e,C2′,3′-O-Ac)、異黃芪皂苷I(C2′,4′-O-Ac)和乙酰黃芪皂苷I(C2′,3′,4′-O-Ac)。其中,黃芪皂苷I和II是黃芪根中最豐富的皂苷。黃芪皂苷具有多種生物活性,如心臟保護、神經保護和免疫調節效應,而乙酰化的數量和位置在很大程度上決定了它們的生物活性。由于黃芪根的化學復雜性,需要進行廣泛的純化才能從至少包含189種化合物的提取物中獲得這些黃芪皂苷。因此,研究黃芪皂苷的生物合成途徑以擴展這些皂苷的來源是必要的。盡管我們之前的研究已經確定了生物合成途徑中的骨架形成的氧化鯊烯環化酶和四種糖基轉移酶,下游的乙酰化步驟仍然不明確。基于特定的底物(三萜C3-木糖)和反應位點(C2′/C3′/C4′),制造黃芪皂苷的ATs應該與以前報道的糖苷ATs顯著不同。
這項工作集中于使用黃芪根作為植物材料,發現并闡明皂苷乙酰轉移酶的催化機制。首先,通過逐步的轉錄組分析發現了一種皂苷乙酰轉移酶AmAT7-3,并對其進行了生化特征分析。其次,獲得了AmAT7-3(PDB:8H8I)的復雜晶體結構,以深入了解催化機制,并采用半理性設計將AmAT7-3改造成區域選擇性酶。還解析了工程變體AmAT7-3A310G(PDB:8HBT)的復雜晶體結構。最后,使用AmAT7-3及其變體修改了具有醫藥重要性的皂苷分子,從而增強了天然產品的結構多樣性。這些結果擴展了對皂苷乙酰轉移酶的蛋白質序列、催化機制和蛋白質工程的理解,并為糖苷乙酰化提供了有效的催化工具。
結果與討論
基因篩選和功能表征
由于糖苷乙酰轉移酶的序列多樣性,采用了逐步的BLAST搜索來篩選黃芪皂苷乙酰轉移酶。首先,我們選取了九種修飾六元環的乙酰轉移酶作為模板(補充表1)。它們的酰基受體包括黃酮糖苷、香草酸和蔗糖。在黃芪的轉錄組(SRR923811)中進行BLASTn搜索,結果發現了16個候選基因(e < 10^-5),這些基因含有保守的基序HXXXD和DFGWG。隨后,這些候選基因被克隆到pET-28a(+)載體中,并在大腸桿菌中表達(補充表2)。在包含30μg蛋白、0.1mM黃芪皂苷IV(1)、0.5mM乙酰輔酶A和0.5mM二硫蘇糖醇的50mM Na2HPO4-NaH2PO4緩沖液(pH 6.0,100μL)中,對純化的重組蛋白的功能進行了表征。反應在30°C下進行了30分鐘。在這些候選物中,AmAT8-17(GenBank存取號OQ915518)在黃芪皂苷IV(1)的C4′-OH位置表現出乙酰化活性,轉化率為25%(補充圖1)。然而,除了其活性較差外,AmAT8-17無法催化C2′-O或C3′-O乙酰化,這些是黃芪皂苷的主要酰化修飾位點。因此,我們使用AmAT8-17作為模板進行了另一次BLASTn搜索,得到了10個額外的候選基因。其中,一個候選基因AmAT7-3(ON804888)被發現可以修飾黃芪皂苷IV(1),產生了三個極性較低的峰(1a,1b,1c),如圖1所示。AmAT7-3的蛋白序列與其他酰基轉移酶沒有聚類,并形成了一個相對獨特的分支,表明其具有高序列特異性(圖1a,b)。AmAT7-3、AmAT8-17和六種已知的糖苷ATs的分布解釋了僅基于蛋白質序列預測乙酰轉移酶功能的挑戰。
1a和1b的質譜顯示其[M+Na]+離子為849.46 Da,比化合物1高出42.01 Da。1c的[M+Na]+離子比1高出84.02 Da。這些結果表明1a/1b為單乙酰化產物,而1c為雙乙酰化產物(圖1c-e)。1及其所有三個產物的MS/MS光譜顯示了180.06 Da的中性丟失,與一個葡萄糖基團和一個水分子一致,表明乙酰化發生在木糖基團上。通過與參考標準比較,進一步確認了產物的結構。產品1a、1b和1c分別被鑒定為C3′-O、C4′-O和C3′, C4′-O乙酰化的黃芪皂苷IV(圖1)。
AmAT7-3在30°C、pH 6.0(50 mM Na2HPO4-NaH2PO4緩沖液)條件下的30分鐘反應中顯示出最高活性,并且它的活性不依賴于二價金屬離子(補充圖2)。AmAT7-3的體外轉化率達到了85.3%,高于許多之前表征的酰基轉移酶。由于AmAT7-3能催化不同位點(C3′和C4′)的乙酰化,我們進行了480分鐘的時間進程實驗以確定其首選位點(圖1d)。產品1a的轉化率在最初2分鐘內迅速增加,然后逐漸降至36.1%。相反,1b和1c的累積在60分鐘內逐漸增加。三種產品的總轉化率在30分鐘達到平臺期。這些結果表明AmAT7-3的首選催化位點為C3′-OH。化合物1b可能是AmAT7-3的直接產物,也可能是由于C3′和C4′上的鄰近羥基而導致的1a的酰基遷移產物。為了澄清這一點,使用1a作為底物。與AmAT7-3共孵育時,生成了41.8%的1c(C3′,C4′-O乙酰化1)。相比之下,與煮沸的AmAT7-3共孵育時,未檢測到1c(圖1f)。這些結果表明AmAT7-3可以修飾1a的C4′位點。此外,從1a到1b的自發轉化率約為6.1%,顯著低于AmAT7-3催化產物中的1b/1a比率56.5%(圖1f對比1c)。這表明AmAT7-3也可以催化1的C4′位點。基于1a的迅速生成,我們推斷1c是通過C3′和C4′的順序乙酰化產生的。
黃芪中黃芪皂苷的推測乙酰化途徑
除了異黃芪皂苷II(1a)和環首皂苷II(1b)外,黃芪中的皂苷還包括黃芪皂苷II(1d)和I(1e),它們分別是1的C2′-和C2′, C3′-乙酰化產物(圖2a)。由于我們篩選了26個候選基因并且在其中沒有發現C2′-乙酰化活性,我們研究了AmAT7-3對C2′-乙酰化產品的貢獻。首先,在煙草中確定了AmAT7-3的亞細胞定位,使用pSuper 1300-GFP載體(圖2b)。GFP-AmAT7-3的熒光信號限制在細胞質中,表明AmAT7-3主要在活細胞的細胞質中表達。在豆科植物中,細胞質環境傾向于略呈堿性,例如綠豆懸浮培養細胞(pH 7.5)和蠶豆氣孔保衛細胞(pH 7.67)。因此,我們在不同的pH條件(Na2HPO4-NaH2PO4,pH 6.0、7.0、8.0)下研究了AmAT7-3產物1a的穩定性,時間為90分鐘(圖2c)。結果表明,盡管在堿性環境下乙酰化皂苷易于水解
(分別為pH 6、7、8下的3.9%、27.7%、49.5%),但在pH 7和pH 8下C2′-乙酰化產品1d的比例顯著增加。在未水解的產品中,1d在pH 6、7、8下的比例分別為4.8%、34.2%和63.5%。為了更好地理解自發的酰基遷移反應,在50 mM Na2HPO4-NaH2PO4,pH 7.6的條件下,使用1a/1b/1d(C3′/C4′/C2′-OAc)作為底物獲得了時間進程。有趣的是,1a和1b在8小時后轉化為1d作為主要的乙酰化產物(在乙酰化產品中為58.7-70.2%),而1d轉化回1a/1b的部分較小(<25%)(圖2d-f)。這些結果表明,AmAT7-3的主要產品1a/1b可以通過酰基遷移轉化為黃芪中的主要皂苷1d。當AmAT7-3在煙草中過表達并與1共滲透作為底物時,也可以觀察到1d的生成(圖2g)。這進一步表明,植物體內的乙酰化產品與體外不同,AmAT7-3可能通過C3′/C4′-O乙酰化和酰基遷移在黃芪皂苷1d和1e的產生中發揮作用。黃芪中C2′-乙酰化皂苷的積累機制需要進一步研究。
a 黃芪根的UHPLC/CAD色譜圖。b AmAT7-3的亞細胞定位。三次獨立實驗顯示了相似的結果。c 在不同pH值下1a降解產物的比例。數據以三次獨立實驗的平均值呈現。d–f 分別為1a、1b和1d的酰基遷移的時間進程。數據以平均值±標準差(n = 2或3次獨立實驗)呈現。源數據為(c–f)提供了源數據文件。g 在煙草(N. benthamiana)中AmAT7-3的瞬時表達。呈現了從農桿菌浸染葉片中提取的UHPLC/MS跡線。EV:空的pSuper 1300-GFP載體的熒光信號;反應:在煙草中瞬時表達AmAT7-3;對照:在煙草中瞬時表達空的pEAQ-HT載體。
晶體結構與AmAT7-3的位點特異性催化機制
AmAT7-3是一種罕見的多位點乙酰轉移酶,能乙酰化大型皂苷分子。為了深入了解其乙酰化機制,我們解析了AmAT7-3/黃芪皂苷IV(1)復合體的晶體結構(PDB ID: 8H8I),分辨率為2.03 ?。據我們所知,之前尚未報道過皂苷酰基轉移酶的晶體結構。我們還嘗試獲得含有乙酰輔酶A或輔酶A的三元復合體晶體結構,但未能成功。與先前報道的酰基轉移酶類似,AmAT7-3的結構被劃分為兩個大致相等大小的域,其中有一個溶劑通道穿過蛋白質分子(圖3a)。值得注意的是,與轉移對香豆酰輔酶A至香草酸的SbHCT(PDB ID: 4KEC)的結構相比,AmAT7-3的活性口袋更大,以容納皂苷分子(圖3b-d)。
a 黃芪皂苷IV與AmAT7-3的復合晶體結構。b AmAT7-3的活性口袋表面。c SbHCT的活性口袋表面。d 黃芪皂苷IV與香草酸,分別為AmAT7-3和SbHCT的底物,分子尺寸比較。e 乙酰輔酶A的乙酰基C與黃芪皂苷IV糖基O位點之間的距離分布。f 乙酰基C與黃芪皂苷IV各糖基O位點之間的距離。g 分子動力學模擬中構象-1的反應瞬態及其與周圍氨基酸的相互作用。h 構象-2的反應瞬態及其與周圍氨基酸的相互作用。i 由AmAT7-3催化的O3′乙酰化反應的QM/MM優化反應狀態。j 構象-1中AmAT7-3/黃芪皂苷IV/乙酰輔酶A的QM/MM計算能量剖面。k 構象-2中AmAT7-3/黃芪皂苷IV/乙酰輔酶A的QM/MM計算能量剖面。AsIV代表黃芪皂苷IV,PS代表對香豆酰香草酸,RC代表反應物復合體,TS1代表過渡狀態1,IM1代表中間體1,TS2代表過渡狀態2,PC代表產物復合體。能量以千卡/摩爾表示,距離以埃表示。
為了理解多位點乙酰化的機制,我們進行了分子動力學(MD)模擬,以研究底物1的結合和動態變化。由于無法通過對接獲得合理的乙酰輔酶A的位置(補充圖3),因此基于SbHCT的已知結構通過疊加將乙酰輔酶A打包到結構中。乙酰基C與各糖基O位點之間的距離分布顯示在圖3e中。觀察到的最短距離為Cx-O3′(2.8 ?),Cx-O4′(3.1 ?)和Cx-O2′(3.8 ?),表明O3′和O4′位點可接近乙酰化,而O2′位點可能較不可接近。由于AmAT7-3的活性口袋相對寬敞,我們在整個MD模擬過程中觀察到木糖基糖環的顯著旋轉運動。基于旋轉角度,我們使用75度閾值將底物分為兩個主要構象(補充圖4)。在構象-1中,O3′和O4′位點分別與K407和H166形成氫鍵。這種氫鍵約束了底物,使O3′位點與Cx靠近,暗示這是一個潛在的選擇性乙酰化位點(圖3g)。隨著糖環的旋轉,它為溶劑水分子進入創造了空間,導致構象-2的出現。在這種構象中,O4′位點接近Cx,而O3′位點保持距離(圖3h)。因此,乙酰化的區域選擇性可以通過兩個主要構象中底物的定位合理解釋。
為了進一步支持上述預測,對構象-1或構象-2中接近攻擊構象的Cx-O3′或Cx-O4′距離的兩個反應瞬態進行了量子力學和分子力學(QM/MM)計算(補充圖5-6)。根據先前的研究,鄰近的His殘基可能在乙酰化反應中充當酸堿催化劑。我們的計算顯示,反應由糖基O原子向His166的質子轉移啟動,這與糖基O對乙酰基Cx的親核攻擊同時進行,導致四面體中間體的形成。隨后,另一個質子從His166轉移到Sx,促進了C-S斷裂并產生了產品1a/1b(圖3i,補充圖7)。為構象-1和構象-2的兩個反應瞬態計算的QM/MM能量剖面分別呈現在圖3j和圖3k中。檢查這些能量剖面揭示了在構象-1中對O3′位點的乙酰化比O4′位點更受青睞,而在構象-2中則相反。MD預測的兩種構象的比例與實驗觀察結果一致,表明O3′的乙酰化比O4′的乙酰化更受青睞(補充圖4)。
工程化AmAT7-3的區域選擇性及其突變體的立體選擇性機制
為了進一步闡明鄰近氨基酸如何影響木糖基(Xyl)組的構象并調節AmAT7-3的區域選擇性,我們分析了AmAT7-3/黃芪皂苷IV(1)的復合結構。除了已確立的H166的關鍵作用(補充圖8)外,發現距離底物5?內的十個氨基酸參與構建活性腔的內部結構。這些氨基酸包括K407, R38, D311, A312, A310, L290, I34, I288, I374和A376(圖4a,補充數據2),它們可能在決定底物構象中起決定性作用。為了研究它們的作用,構建了一個突變體庫,選擇了七個氨基酸作為替代殘基,包括Ala/Val(非極性,脂肪族)、Trp/Phe(非極性,芳香族)、Gly(極性,無電荷)、Asp(酸性)和Arg(堿性)。使用純化的蛋白質對突變體的功能進行了表征,采用與野生型相同的程序。黃芪皂苷IV(1)和乙酰輔酶A分別用作底物和酰基供體。有趣的是,幾個突變體顯著增強了對C3′-OH的區域選擇性(圖4b-d)。例如,L290V突變體特異性修飾C3′-OH,其轉化率為79.1%,而野生型為35.1%。另一方面,四個突變體特異性修飾了1的C4′-OH,如A310W,其轉化率為53.1%(野生型為19.8%)。更有趣的是,A310的突變體表現出不同的選擇性(圖4d)。A310D/G/R選擇性催化1的C3′-OH乙酰化,而A310F/W特異性青睞C4′-OH。此外,我們分析了野生型和突變體的動力學參數(補充圖9-10)。AmAT7-3A310G對1a的Km和kcat/Km值分別為76.7 μM和0.6 mM?1s?1,而AmAT7-3A310W對1b的為168.3 μM和0.19 mM?1s?1。與野生型相比,相似范圍的動力學參數表明,這些突變改變了區域特異性,而不降低催化效率。
a 活性口袋中1周圍5?范圍內的氨基酸。b AmAT7-3的突變體庫及不同突變體產生的1a/1b/1c比例。c 由AmAT7-3及其突變體催化的反應樣品的UHPLC/MS色譜圖。d 具有特異性C3′-OH或C4′-OH乙酰化活性的突變體。e AmAT7-3A310G(青色)與野生型(來自構象-1,灰色)的QM/MM優化反應物復合體的疊加。f AmAT7-3A310W(青色)與野生型(來自構象-1,灰色)的QM/MM優化反應物復合體的疊加。g AmAT7-3A310G/W/1/Ac-CoA的QM/MM計算能量剖面(以千卡/摩爾為單位)。AsIV代表黃芪皂苷IV(1)。h AmAT7-3與其他黃酮或皂苷乙酰轉移酶的序列比對。i AmAT7-3的β10桶中YFGN和AADAG基序的位置。RC代表反應物復合體,TS1代表過渡狀態1,IM1代表中間體1。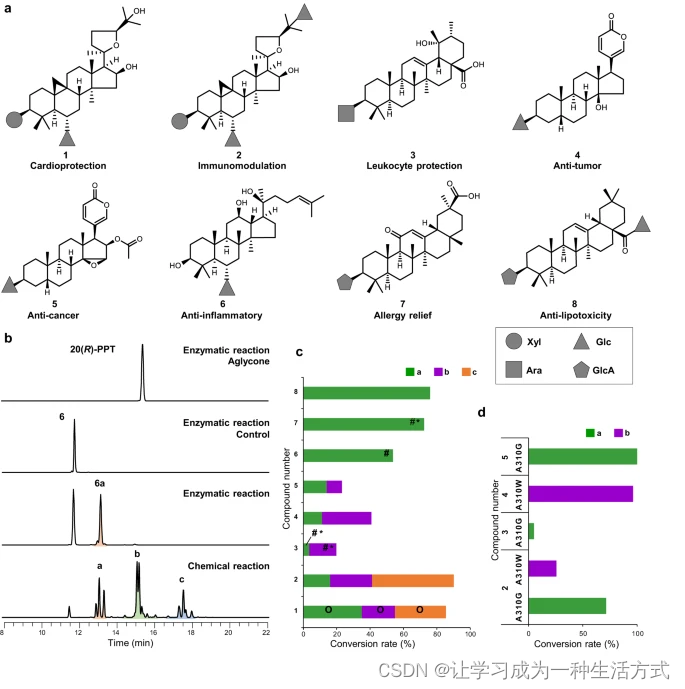
a 化合物1-8的結構和生物活性。b 由AmAT7-3或化學試劑催化的6的乙酰化反應。PPT表示人參三醇,a/b/c表示單/雙/三乙酰化產物。c 由AmAT7-3催化的乙酰化產物的轉化率。O:通過與標準品比較確定;#:通過NMR制備并鑒定;*:以前未報道的化合物。d 由AmAT7-3A310G和AmAT7-3A310W催化的乙酰化產物的轉化率。
除了木糖基團(1-2),AmAT7-3還能識別包括葡萄糖基(4-6)、阿拉伯糖基(3)和葡萄糖醛酸(7-8)在內的其他糖基(圖5c)。制備了四種單乙酰化產物,其結構通過NMR光譜分析表征(補充圖25-53,補充表3-6)。其中,3a、3b和7a以前未報道。NMR光譜顯示所有四個產物中出現了新的碳信號(δC 171.0-171.3)和新的甲基信號(δH 1.97-2.11,s,3H),表明成功進行了乙酰化。乙酰化位點通過HMBC相關進一步確認。例如,在產物3a中,觀察到H-3(δH 3.33)與C-2(δC 27.0)/C-4(δC 39.9)以及新出現的羰基碳(δC 171.3)之間的HMBC相關,從而確定化合物3a為C3′-O乙酰化的紫云英皂苷II。同樣,產物6a、7a和3b分別被確認為C6′-OH、C3′-OH和C4′-OH的乙酰化產物。這些結果展示了AmAT7-3在與各種糖基及皂苷分子不同位點反應中的多功能性。根據配體相互作用模式的檢查(補充圖54),底物通用性背后的結構基礎可能源于活性口袋的大體積,有助于容納較大的皂苷分子。皂苷的定位可能由諸如R38和E39等保守氨基酸決定,這些氨基酸與糖基形成氫鍵。
雖然對于化合物6-8生成單一產品,但AmAT7-3催化的化合物2-5形成了2到3種產品,類似于觀察到的化合物1的反應。為了提高區域選擇性,我們使用區域選擇性突變體AmAT7-3A310G和AmAT7-3A310W來催化2-5的乙酰化(圖5d)。正如預期的那樣,突變體顯示出比野生型酶更高的區域選擇性。例如,野生型酶對5的轉化率為23.1%,包含兩種產品比例為14:9。A310G變體催化5生成單一產品,轉化率為96.3%。這些發現進一步確認了310位點殘基在塑造活性腔并突出區域特異性乙酰化在未來制備單乙酰化產物中的潛力的關鍵作用。
總之,我們使用逐步BLAST方法表征了來自藥用植物黃芪的皂苷乙酰轉移酶AmAT7-3。我們解析了AmAT7-3及其變體A310G與黃芪皂苷IV的復合體晶體結構。AmAT7-3顯示出與報道的乙酰轉移酶不同的獨特蛋白序列,并且是少有的具有晶體結構的皂苷乙酰轉移酶。它可以催化黃芪皂苷IV(1)的C3′/C4′-O乙酰化以及其他七種藥用重要皂苷的乙酰化。總共制備了四種產物,其中三種以前未報道過。結構分析揭示了AmAT7-3具有由特定序列AADAG決定的大型活性口袋,其區域選擇性由關鍵氨基酸如A310、L290、K407、D311和A312通過糖環在活性口袋中的定位控制。為了增強其區域特異性,我們基于半理性設計構建了一個小型突變體庫。變體A310G和A310W分別被發現可以催化黃芪皂苷IV(1)的特異性C3′-O和C4′-O乙酰化。此外,這些突變體在修改生物活性皂苷2-5時顯示出更高的區域特異性。這項工作提供了糖苷乙酰轉移酶的蛋白序列、催化機制和半理性工程的洞察,并提供了高效的皂苷乙酰化催化工具。
方法
通用方法
從成都慕斯生物技術有限公司購買了以下化合物:黃芪皂苷IV(1),紫云英皂苷II(3),人參皂苷Rh1(6),甘草次酸3-O-β-D-葡萄糖苷(7),筑澤皂苷IVa(8),異黃芪皂苷II(1a),環頭皂苷II(1b),3-O-3′,4′-二乙酰基-β-D-木糖吡喃基-6-O-β-D-葡萄糖吡喃基環黃芪甲素(1c),黃芪皂苷II(1d)和黃芪皂苷I(1e)。黃芪皂苷VII(2),牛蒡苷3-O-β-D-葡萄糖苷(4)和蟾蜍苷3-O-β-D-葡萄糖苷(5)按先前報道的方法制備27,37,43。乙酰輔酶A從上海柱子生物科技有限公司購買。甲醇和乙腈(UPLC級)從美國費希爾科學公司購買。
植物材料
黃芪(A. membranaceus)種子從中國河北省安國市豐華種子站購買。根據先前發表的方法27培育兩周后獲得幼苗,并用于基因克隆。在中國黑龍江省大興安嶺采集黃芪根樣本,用于化學分析。
系統發育分析
采用基于JTT矩陣的最大似然方法推斷進化歷史44,并在MEGA7軟件中進行進化分析45。啟發式搜索的初始樹通過應用鄰接連接和BioNJ算法自動獲得,以估算使用JTT模型的成對距離矩陣。選擇了對數似然值最優的拓撲結構。自舉值為1000。
基因克隆和蛋白表達
使用TranZolTM試劑盒(中國全式金生物科技公司)提取總RNA,并使用FastQuant RT試劑盒(中國天根生物科技公司)逆轉錄為cDNA。設計特異性引物來擴增AmAT7-3和AmAT8-17,隨后將其克隆到pET-28a(+)載體中(美國Invitrogen公司)。使用補充數據2中的特異性引物和Fastpfu Fly菌落試劑盒(中國全式金生物科技公司)構建突變質粒。測序后,將重組質粒轉化到大腸桿菌BL21(DE3)(中國全式金生物科技公司)。在37°C下培養細菌株于加有50μg/mL卡那霉素的LB培養基中,直到OD600達到0.6。然后加入異丙基-β-D-硫代半乳糖苷(IPTG,0.1 mM)誘導蛋白表達,并在16°C下繼續培養20小時。
蛋白純化與結晶
通過超聲破碎并離心去除碎片后,用Ni-NTA柱(中國全式金生物科技公司的Proteinlso Ni-NTA樹脂)純化上清,并使用Amicon Ultra-15 Ultracel-30K離心濾器(Merck Millipore)濃縮蛋白。使用特異性引物將AmAT7-3進一步克隆到pET28a-TEV載體中,并通過GE healthcare的SuperdexTM柱進行尺寸排阻色譜純化。使用TransGen Biotech的蛋白定量試劑盒測定蛋白濃度,并通過SDS-PAGE檢查純度(補充圖4)。
純化的蛋白(AmAT7-3和AmAT7-3A310G各20 mg/mL)與5 mM乙酰輔酶A和5 mM黃芪皂苷IV(1)在冰上孵育1小時。AmAT7-3/1和AmAT7-3A310G/1的晶體通過懸掛滴蒸發法準備。在含有1μL蛋白溶液和1μL儲備液(1.6 M硫酸鎂,100 mM MES/氫氧化鈉pH 6.5)的懸掛滴中獲得立方晶體,3周后收集。在上海同步輻射設施的BL19U1光束線上進行晶體衍射和數據收集,使用HKL-2000程序套件。通過分子替換法構建初始晶體學相位,基于alphafold 2預測的AmAT7-3結構。使用CCP4、Wincoot和Phenix進行蛋白模型構建和細化。結構的詳細信息列在補充表7中。使用Pymol顯示晶體結構中配體的Fo-Fc遺漏圖(補充圖55)。
UHPLC/MS分析酶促反應產物
為了表征催化活性,通過在30°C下將30μg純化蛋白、0.1 mM黃芪皂苷IV(1)、0.5 mM乙酰輔酶A和0.5 mM二硫蘇糖醇混合在50 mM Na2HPO4-NaH2PO4緩沖液(pH 6.0)中反應30分鐘,制備100μL反應混合物。用200μL甲醇終止反應,濃縮至干,重新溶解于200μL甲醇,并離心21130g 20分鐘。將所得上清液用ThermoFisher Scientific的Vanquish UHPLC系統與帶有加熱電噴霧電離源的Q-Exactive四極桿-軌道阱質譜儀聯用進行UHPLC/MS檢測。樣品在Waters T3柱(2.1×100 mm, 1.8μm)上使用0.1%甲酸(體積分數,A)和乙腈(B)在50°C下分離。使用梯度程序:0-1分鐘,8% B; 1-19分鐘,8-47% B; 10-16分鐘,47-65% B; 16-19分鐘,65-100% B; 19-22分鐘,100% B。流速為0.3 mL/min。MS分析在正負離子模式下進行,參數為:噴霧電壓:±3.5 kV;毛細管溫度:350°C;剪切氣體:45 arb;輔助氣體:10 arb;探頭加熱器溫度:400°C;S-lens RF水平:60 V;分辨率:全MS 70000,MS/MS 17500;掃描范圍:m/z 100-1200;階梯NCE:35 eV。數據使用XcaliburTM 4.1軟件處理(Thermo Fisher Scientific)。使用HPLC(SSI-III)聯用ELSD 6000(Alletch Chrom, USA)分離反應混合物。
)






。Javaee項目。ssm項目。)




 | 文件系統和諧共處的基礎)

)


并不可怕,可怕的是...)

![[ACTF新生賽2020]SoulLike](http://pic.xiahunao.cn/[ACTF新生賽2020]SoulLike)