在微生物實驗中,細菌濃度的精準測定和菌種的準確鑒定是兩項基礎且核心的操作。本文將詳細介紹相關技術的原理、操作步驟及注意事項,為新手提供系統性指導。
一、細菌濃度測定方法
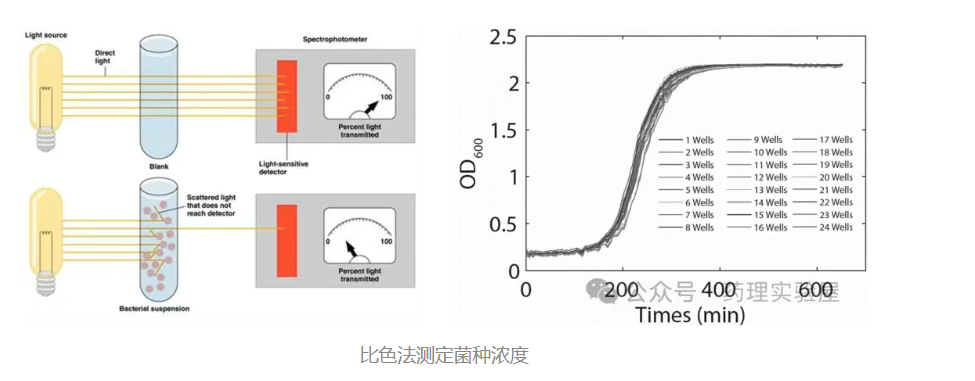
1. 光密度法(OD600):快速定量的首選
原理
OD600 測定基于光散射原理:當 600nm 波長的光穿過菌液時,細菌會對光產生散射,散射強度與菌液中細菌濃度在一定范圍內(通常 0.1-0.8 OD 值)呈線性正相關。需注意,超過此范圍后線性關系會偏離,例如大腸桿菌在 OD600>0.8 時,數據準確性顯著下降。
操作步驟
- 儀器校準:以空白培養基作為對照調零,建議使用中性密度濾光片驗證儀器精度;固定使用同一臺儀器,并記錄比色皿光程(通常為 1cm)。
- 樣品準備:輕柔混勻菌液(避免產生氣泡影響測定),若 OD 值超過 0.8,需用無菌培養基稀釋至 0.1-0.8 范圍后再測定。
- 測量操作:用擦鏡紙清潔比色皿外壁,每個樣品讀取 3 次取平均值,以減少誤差。
- 濃度計算:最終濃度 = 測定 OD 值 × 稀釋倍數。建議提前繪制 OD 值與活菌數(CFU)的標準曲線,便于直接換算活菌濃度。
注意事項
- 若培養基顏色較深,可通過離心收集細菌沉淀,用 PBS 洗滌后重懸再測定,避免背景干擾。
- 不同儀器的測定結果存在差異,需固定儀器并定期校準,記錄光程參數以保證數據可比性。
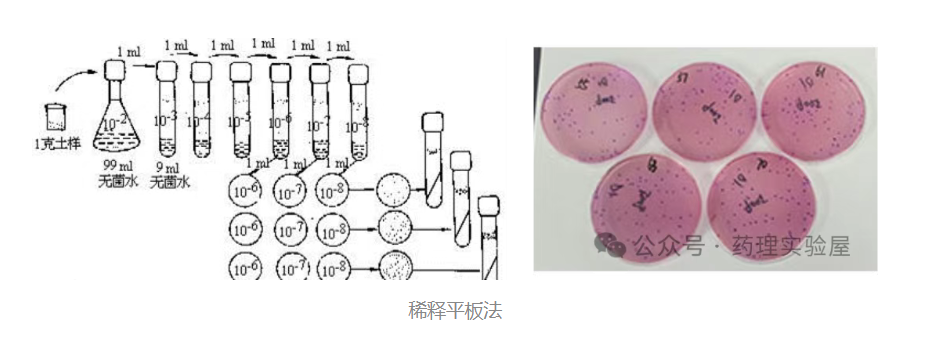
2. 平板計數法:活菌定量的 “金標準”
核心概念:CFU
CFU(菌落形成單位)指能在固體培養基上形成一個菌落的活細菌個體(可能是單個細菌或團聚的細菌群),僅反映活菌數量,是活菌定量的直接方法。
計算公式
plaintext
CFU/mL =(菌落數 × 稀釋倍數)÷ 接種體積(mL)
操作流程
- 樣品稀釋:采用無菌生理鹽水或 PBS 進行 10 倍梯度稀釋(如 10?1 至 10??),每稀釋度更換無菌槍頭,防止交叉污染。
- 培養基制備:選擇適宜的固體培養基(如 LB 瓊脂),滅菌后冷卻至 50℃左右倒平板,90mm 直徑平板的培養基用量約 20mL,厚度均勻可保證菌落生長一致性。
- 接種方法:
- 涂布法:取 100μL 稀釋液滴加至平板,用無菌涂布棒均勻涂布。
- 傾注法:取 1mL 稀釋液與融化的瓊脂培養基混合后倒平板。
- 培養條件:根據細菌特性設置溫度(通常 30-37℃),培養 18-48 小時,保持培養環境濕度適宜。
- 計數規則:選擇菌落數在 30-300 之間的平板計數,菌落數過少或過多均會導致結果偏差,可借助菌落計數器提高效率。
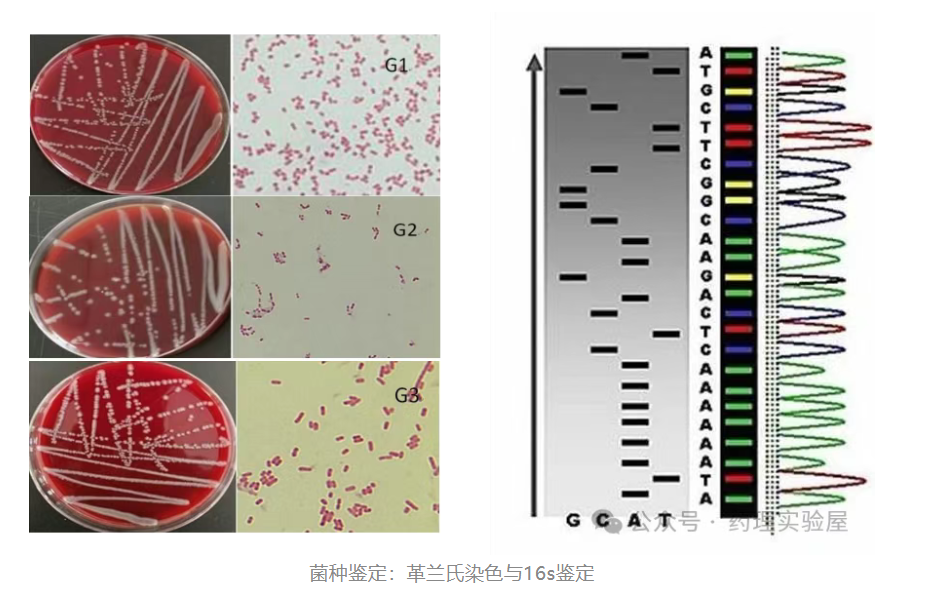
二、菌種鑒定技術
1. 傳統鑒定方法
革蘭氏染色:細胞壁特性鑒別
- 原理:革蘭陽性菌細胞壁較厚,含肽聚糖多,與結晶紫結合穩定,經酒精脫色后仍保留紫色;革蘭陰性菌細胞壁薄,肽聚糖少,結晶紫易被洗脫,復染后呈紅色。
- 操作要點:
- 涂片厚度適中,避免重疊影響觀察。
- 染色步驟嚴格控制時間:結晶紫染色 1 分鐘→碘液媒染 1 分鐘→酒精脫色 30 秒(關鍵步驟,時間需精準)→番紅復染 30 秒。
氧化酶試驗:呼吸類型輔助判斷
- 原理:檢測細菌是否含細胞色素 c 氧化酶,陽性菌可使四甲基對苯二胺試劑在 30 秒內變藍,陰性菌無顏色變化。
- 注意事項:使用新鮮培養的細菌,避免用含鐵工具接觸試劑,防止假陽性。
2. 分子鑒定方法:精準到種級
16S rRNA 測序:細菌 “分子身份證”
- 原理:16S rRNA 基因在細菌中高度保守且種間存在特異性差異,長度約 1500bp,數據庫完善,通過序列比對可實現精準鑒定。
- 操作關鍵:
- DNA 提取:選用對數期細菌(OD600≈0.6),革蘭陽性菌需用溶菌酶預處理以破壞細胞壁,提取后用 RNase 去除 RNA 污染。
- PCR 擴增:常用引物 27F(5'-AGAGTTTGATCMTGGCTCAG-3')和 1492R(5'-TACGGYTACCTTGTTACGACTT-3');反應程序:94℃預變性 5 分鐘,35 個循環(94℃變性 30 秒→55℃退火 30 秒→72℃延伸 90 秒),最后 72℃延伸 10 分鐘。
- 序列分析:拼接測序結果后,通過 NCBI BLAST 等工具與數據庫比對,確定菌種分類。
總結
細菌濃度測定中,OD600 法適合快速定量,平板計數法適合活菌精準計數,兩者可結合使用(如通過標準曲線關聯 OD 值與 CFU)。菌種鑒定方面,傳統方法(革蘭氏染色、生化試驗)可快速初步分類,分子方法(16S rRNA 測序)可實現精準鑒定。實際操作中需根據實驗目的選擇合適方法,并嚴格遵循無菌操作與實驗規范,以保證結果可靠性。
通過掌握上述基礎技術,可為后續微生物功能研究、發酵優化等實驗奠定堅實基礎。
數據庫容量規劃)
)







)





完全指南:從入門到精通)



詳解)