本筆記基于楊榮武教授第四版《生物化學》(持續更新)
1. 多肽
我們在上一節筆記里面介紹了什么是氨基酸,還有氨基酸的種類以及氨基酸基本的一些性質如等電點極性手性等等,這里我們開始介紹氨基酸結合的產物,因為氨基酸是脫水縮合形成多聚體(這里說聚合體應該更加恰當,因為參與的氨基酸數量不一定足夠多),所以其實在肽/蛋白質里面的氨基酸已經不是原來完整的氨基酸,我們稱此時經過縮合的氨基酸單位為氨基酸殘基。
那么根據氨基酸脫水縮合(這里有必要強調氨基酸脫水縮合第一點不一定是核糖體上進行的第二點即使在核糖體上進行的,也不是簡單“相遇”就可以脫水的,每一次脫水縮合需要消耗2個ATP)形成的聚合體的長度(用組成氨基酸數量表示),人為地劃分為如果2-10個氨基酸則是寡肽,如果11-50個氨基酸就是多肽,如果50個以上的氨基酸認為是蛋白質。請注意這里的人為操作,其實我認為我們不能用這個氨基酸的數量就限制我們應該如何定義肽和蛋白質的界限。我認為如果多聚體有嚴格的三維結構,并且這個結構與其功能高度相關,比如有特定的結構域,那么我們就可以把這個聚合體認為是蛋白質,哪怕這個蛋白質的氨基酸數量少于50個(其實我們看到胰島素,這個人類最先測序的蛋白質的氨基酸數恰好就是51,所以可以認為50就是一個人為限定的因素,自以為沒有必要太當一回事,只是一般氨基酸數如果少于50個那么比較大可能是沒有辦法形成復雜的空間結構的,所以不能說是蛋白質)
然后教材里面有提到目前發現的蛋白質的平均的氨基酸數,那么按照三界來分類細菌、古菌和真核生物的平均蛋白質氨基酸分別是283、311、438,其實課本上也問到為什么呈現出一個遞增的趨勢,尤其是真核生物顯著增多。我想到的是,從細菌到古菌到真核(這里不強調什么進化含義,即使有證據顯示真核是古菌進化而來的),從細菌到古菌,因為古菌生活的環境是更為惡劣的,所以蛋白質可能需要更多的氨基酸來維持結構的穩定性,那么到真核生物主要是因為細胞對于生命活動復雜度的要求升高,所以需要結構更復雜,功能更特化的蛋白質來行使功能,所以所需要的氨基酸數量也會增大。
同時教材里面也提到了有些蛋白質的氨基酸數是非常非常巨大的,那么這里小編想到一個問題,首先如果這個蛋白質是不會動態解聚的,那么合成如此巨大的蛋白質其實要冒著極大的風險的,因為組成蛋白質的氨基酸數量越多那么合成蛋白質的過程就有越多出錯的可能性,那么一旦其中有合成出錯,那么前面合成付出的能量僅僅可以部分收回,其實對于能量來說是一個巨大的浪費,所以可能也是因為這個原因,這種巨大的蛋白質基本上是動態解聚的,降低合成出錯可能,同時這些蛋白應該也是結構蛋白,因為再復雜的功能可以分步完成,沒有必要冒著這么大風險合成如此巨大蛋白質。
然后介紹了肽是如何命名的,這里我不打算詳細記錄,因為很多情況我們也不會去看這么長的命名,簡單來說就是我們把游離的氨基這一段作為起始點位,然后一次念組成的氨基酸。舉一個小小三肽的例子,GAT,那么我們應該這么命名,甘氨酰丙氨酰蘇氨酸,以此類推就好。
然后我們再來介紹肽的一些基本性質,這里沒有考慮到肽在生理環境下的具體作用比如催產素(九肽)可以調節情緒,促甲狀腺素釋放因子(三肽)可以促進甲狀腺素釋放,僅僅是從氨基酸的角度來考慮。
那么我們在氨基酸這里講到過氨基酸是有手性的(除Gly),那么這里同理,只要這個肽不是Gly組成的聚合體,那么這個肽就會存在手性。然后我們又介紹氨基酸等電點的定義和性質,這里也是相同的方式定義的,但是在這里因為單個肽上可能存在著多個可解離的基團(在R上),所以實際上去做滴定實驗就會很困難,因為可能存在著多種帶電狀態,當然了,理論上仍然是可行的。但是與氨基酸性質不同的是,寡肽(>2)內部存在多個肽鍵,所以可以發生雙縮脲反應。那么在高中我們也講過雙縮脲反應其實是Cu2+與肽鍵的配位反應,那么Cu2+一般需要4-6個的配位鍵可以達到穩定,那么單個的肽鍵只可以提供1個配位鍵(另外一個由OH-提供,可以簡單認為提供一對吧),那么這也就是為什么二肽是沒有辦法發生雙縮脲反應(沒有辦法形成穩定的五元環絡合物)
但是我們根據這個反應機理也可以意識到,肽的空間結構可能也會對這個反應能否發生有著一定的影響的。
我們把天然存在的寡肽稱之為活性肽(因為一般具有一定生理活性)可以有兩種來源,一種是有基因編碼,tRNA運輸的,在核糖體合成的,那么對于這一種肽來說,所有的氨基酸都是L型的,還有一種活性肽是不在核糖體上進行合成的,是經過一系列酶促反應發生的,那么由于這里不涉及tRNA運輸等等,所以這里的活性肽可以摻雜D型氨基酸,比如常見的有谷胱甘肽(有非常重要的生理意義)和細菌細胞壁的肽聚糖。
2. 蛋白質的結構
我們把僅僅由氨基酸組成的蛋白質稱之為簡單蛋白,含有非氨基酸成分的稱之為綴合蛋白。那么這些非氨基酸成分可能會有:1.在氨基酸側鏈上通過共價修飾引入的基團(回憶一下在氨基酸章節有提到過一般這些共價修飾是發生在極性氨基酸上的,因為可以更好調控蛋白質作用)2. 與蛋白質結合的無機成分,通常是一些金屬離子(比如血紅蛋白里面就結合了鐵離子)3. 與蛋白質結合并不緊密的有機分子,稱之為輔酶,4.與蛋白質結合緊密的有機分子,稱之為輔基,后面三種非氨基酸成分是蛋白質行使功能所必需的,所以我們一般稱之為輔因子,蛋白質可以分為一二三四四個結構層次,但是注意并不是所有蛋白質都是具有這四個層級的。
1. 蛋白質的一級結構?
蛋白質的一級結構也稱為蛋白質的共價結構,這是蛋白質最基本的結構或者說也是各個層次結構中最穩定的,因為蛋白質的一級結構的維持是依靠著共價鍵的作用。那么在一級結構中我們主要考慮的作用就是共價作用,包括了肽鍵和二硫鍵(一定要注意二硫鍵是共價鍵哦,所以是穩固一級結構的作用之一)
這里有必要去詳細介紹一下肽鍵,因為在高中我們的認知就僅僅局限于肽鍵就是氨基和羧基拖說形成的鍵,然后用單鍵表示。但是我們需要知道,在化學當中,化學鍵只不過是形象表征原子之間相互作用的一種方式而已,所以即使肽鍵用單鍵表示,也只是因為綜合考慮鍵能、鍵長、空間參數等等,認為單鍵占比更大而已。其實肽鍵中有40%可以認為是雙鍵(這個比例也是綜合考慮諸多因素得出的),為什么呢?因為在羰基的碳氧雙鍵可以與碳氮單鍵之間發生共振,雖然羰基結構是更為穩定的共振式,但是另一種共振式的存在也賦予了肽鍵以雙鍵的性質。肽鍵具有雙鍵的性質更加重要的作用是使得與肽鍵有關的六個原子可以認為是處于同一個平面上的(這里我們需要考慮到一個參數為旋轉能壘,肽鍵的旋轉能壘大致在80-120kJ/mol,這在正常的生理環境下是幾乎不可能旋轉的),我們稱這個平面是肽平面。這里截取楊榮武老師主編生物化學(第四版)的一幅圖
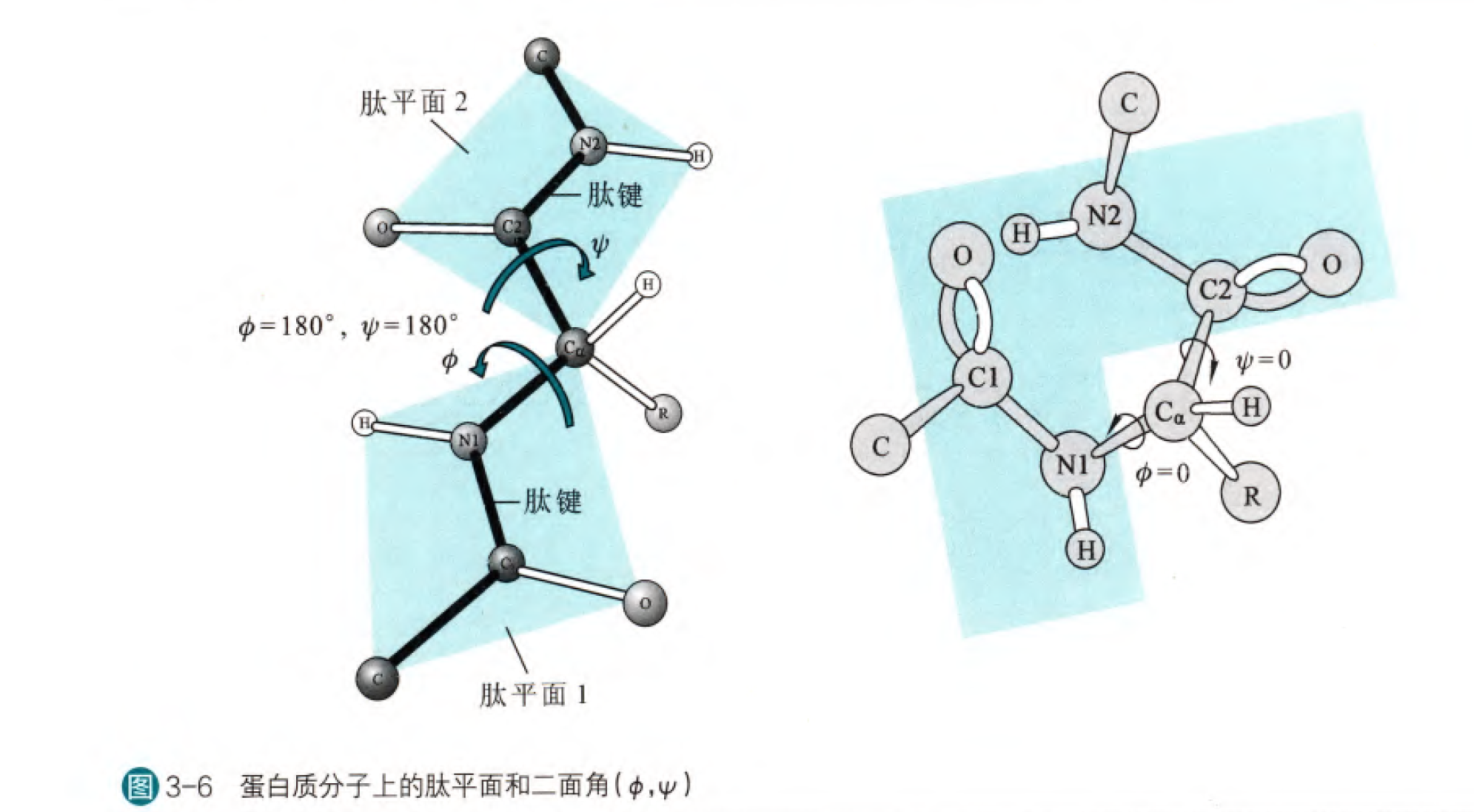
我們首先看右邊這幅圖,C1、N1、H、C、O和Cα都是在一個平面內,同理C2N2為中心的平面。那么我們把Cα與N1的鍵轉動角度記為Phi角,Cα與C2的鍵轉動角稱為Psi角。先看Phi角,如果C1與C2是同平面順式,那么此時Phi角記為0,同理如果N1與N2時是同平面順式,那么Psi角記為0。我們從Cα向N1看過去,如果順時針旋轉鍵,那么phi為正,反之為負。從Cα向C2看過去,如果順時針旋轉鍵,那么Psi為正,反之為負。那么實際上Phi和Psi均為0度是幾乎不能存在的,因為會有很大的空間位阻,這也是我們需要后面考慮肽平面二面角的重要因素。
那么我們可以想到,不是所有的Phi和Psi都是可以取到的,很重要的取決因素就是空間位阻,特別是由R基團引起的空間位阻。那么我們首先來看兩個較為特別的例子,甘氨酸和脯氨酸。
甘氨酸的R僅僅是一個H原子,所以這就提供了甘氨酸殘基以充分的自由旋轉,所以甘氨酸所可以取到兩個角度也就是最廣的。但是反過來看脯氨酸,因為脯氨酸的氨基(實際上是亞氨基)正好和其的R形成一個五元環,所以由于這個環的限制,使得Cα-N1鍵基本上是固定的(本質上是因為原本更加自由的N現在受到五元環R側C的連接因此受限,也就是原本N1旋轉考慮到的是與R的空間位阻應當盡可能小,但是現在直接與R相連,那么考慮到的因素是保證肽平面各個夾角接近120度的同時使得環張力盡可能小,這就使得Phi角幾乎被鎖定在-60度,在此轉角可以使得環張力盡可能小,但是為什么是-60度呢,首先解釋60度是因為這個吡咯烷環是以半椅式構象存在,夾角接近60,取負是因為氨基酸的手性)
其實之前也有提到,順式構象的空間位阻一般是較大的,所以巨大多數肽鍵都是采取反式構象。但是特例仍然是脯氨酸造成,由于脯氨酸特別的環結構,使得順式和反式的能量差異其實不是很大(順式比反式高2-4kJ/mol,其余氨基酸在12-14kJ/mol),所以肽鍵有實現順式的可能。但是需要注意的是,在形成肽鍵(在核糖體合成的蛋白質,如果是在其他酶系統合成的多肽會有例外)的時候,所有的氨基酸都是以反式連接的(這是由于核糖體的立體選擇性造成的),那么脯氨酸可以在以反式方式連接完成之后在肽基脯氨酰順反異構酶(PPI)作用下轉變為順式。(從結構上看,甘氨酸形成順式的比例也會相較于除脯氨酸的其他氨基酸而言較大)
那么,既然有些Phi和Psi的角度是不可以取的(其實能夠取的大約只有10%),那么根據空間位阻等數據可以計算出哪些(Phi,Psi)是禁忌的,根據這個思路做出了Ramachandran圖(具體不細說,因為涉及到的知識目前無法計算和求證)
如果我們知道了蛋白質的一級結構(氨基酸排列順序)同時也知道了各對(Phi,Psi)那么我們其實就已經知道了這個蛋白質的三維結構,但是由于蛋白質的二面角受到了很多作用力的影響,所以實際計算有很大的困難。

)




Modbus)


)
- Weblogic SSRF漏洞)


)

)



![[光學原理與應用-422]:非線性光學 - 計算機中的線性與非線性運算](http://pic.xiahunao.cn/[光學原理與應用-422]:非線性光學 - 計算機中的線性與非線性運算)