腸道菌群及其代謝產物與肥胖相關疾病(如2型糖尿病)密切相關,但其因果關系和潛在機制尚不清楚。研究表明,肥胖與腸道微生物的豐度和多樣性變化有關,例如,高脂飲食(HFD)誘導的肥胖會增加某些細菌的百分比,導致腸道炎癥。此外,腸道菌群轉移實驗表明,腸道菌群失衡對肥胖發展至關重要。然而,腸道菌群衍生的代謝產物如何影響宿主的代謝綜合征(如胰島素抵抗)仍不清楚。

2024年07月04日,同濟大學生命科學與技術學院鄧寒松教授團隊在The EMBO Journal(IF:9.4)發表了題為Gut microbiota metabolite tyramine ameliorates high-fat diet-induced insulin resistance via increased Ca2+?signaling的研究論文,該研究以果蠅和小鼠為模型,探討了腸道菌群代謝產物酪胺(Tyramine, TA)如何通過增加細胞質Ca2+信號來抑制高脂飲食引起的胰島素抵抗。愛基百客為本研究提供了16s rDNA測序技術支持。

研究結果
1.?HFD通過Gαq/PLCβ/IP3R級聯激活腸細胞內的cytoCa2+來減少脂質積累
腸細胞(ECs)是腸道中主要的細胞類型,負責營養物質的消化和吸收。研究者測試了cytoCa2+(細胞質Ca2+)是否參與了ECs中的飲食脂質代謝。在雙光子顯微鏡下利用相對熒光比率量化ECs(腸細胞)中的cytoCa2+?(Fig.?1A),與對照組Ctrl相比,SercaRi果蠅ECs中的cytoCa2+水平分別顯著增加,?IP3RRi果蠅ECs中的cytoCa2+水平顯著的減少(Figs.1B,C)。通過ORO染色檢測了腸道中的中性脂質水平,通過TAG(三酰甘油)定量全身的脂質水平,SercaRi果蠅腸道和全身的脂質水平降低,IP3RRi果蠅腸道和全身的脂質水平則升高(Figs.1D-F),這些結果表明,腸道Ca2+能夠調節腸道和全身的脂質代謝。在 ND(正常飲食)或HFD(高脂飲食)喂養4天后,腸道中中性脂質水平的定量檢測發現,僅4天的HFD就足以增加腸道脂質水平(Figs.1G),ECs中的SercaRi可以抑制這一效應(Fig.?1H)。與ND相比,HFD喂養的果蠅其ECs中的cytoCa2+水平顯著升高(Figs.1I)。進一步的實驗表明,敲除IP3R受體或Gαq能顯著抑制HFD引起的cytoCa2+水平升高(Figs.1J,K)。這些結果表明,腸細胞中的cytoCa2+通過Gαq/PLCβ/IP3R級聯反應調節腸道和全身脂質代謝,并且HFD激活了腸細胞中的cytoCa2+信號以減少脂質積累。
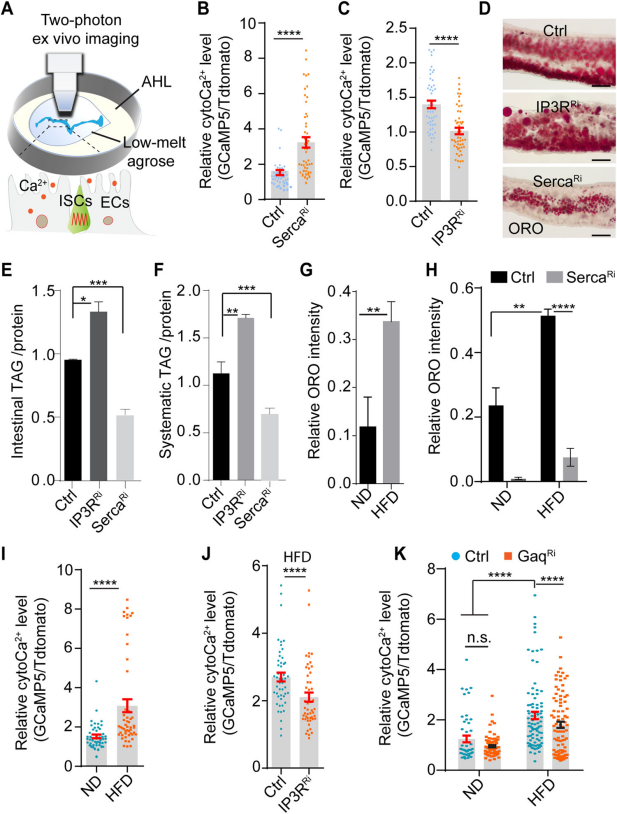
Fig1. HFD通過Gαq/PLCβ/IP3R級聯激活腸細胞內的cytoCa2+來減少脂質積累
2.?HFD誘導的酪胺激活腸細胞cytoCa2+信號
研究者試圖確定HFD誘導的ECs內cytoCa2+水平增加的來源。用椰子油衍生的自由脂肪酸混合物(FFAs mix)喂養果蠅4h后,ECs內的cytoCa2+水平基本不變(Fig.2A)。然而,當果蠅被喂食來自HFD果蠅的腸道裂解液后,ECs內的cytoCa2+水平升高(Fig.2B,C)。這些結果表明,腸道裂解液中的代謝物可能在HFD激活的ECs內cytoCa2+水平升高過程中起作用。
對喂食HFD或ND 4天的果蠅的腸道裂解物進行了廣泛靶向代謝組學分析。通過OPLS-DA的火山圖顯示了HFD與ND條件下腸道裂解液的1461種代謝物的變化,其中175種代謝物表現出顯著差異,特別是酪胺(TA)水平在HFD條件下顯著上調 (Fig.2D)。進一步實驗表明,喂食含TA飼料的果蠅在一天內表現出腸細胞內cytoCa2+濃度的劑量依賴性增加(Fig.2E),且TA暴露能迅速并持續地增加新鮮分離腸道的細胞內cytoCa2+水平(Fig.2F)。這些結果表明,HFD條件下腸道微生物群產生的酪胺(TA)是激活腸細胞Ca2+信號的源頭。
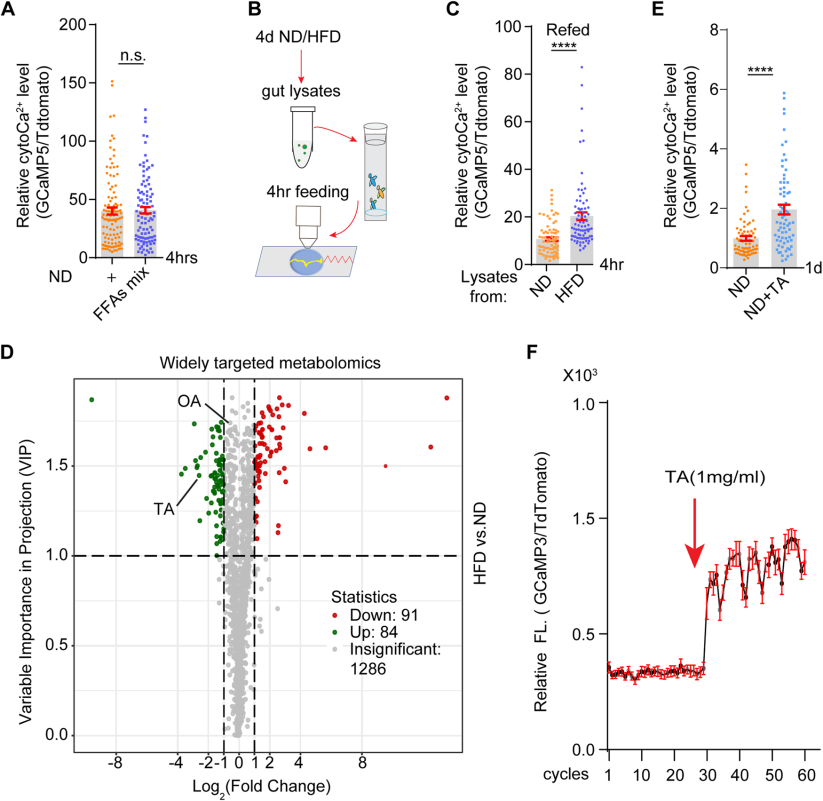
Fig2. HFD喂養的果蠅腸道中酪胺的增加激活了腸道中cytoCa2+信號
3.?由HFD增加的革蘭氏陽性菌負責TA的產生
通過平板計數法(CFU)測定了HFD喂養4天或15天后果蠅腸道裂解物中的細菌數量,顯示HFD顯著增加了腸道細菌負荷 (Fig.3A)。用抗生素混合物處理(HFD+組)顯著降低了HFD喂養果蠅腸道裂解物中的cytoCa2+水平(Fig.3B),并且抗生素處理進一步增加了HFD條件下腸道中的中性脂質水平(Fig.3C)。這表明腸道微生物群參與了HFD介導的cytoCa2+調控。
通過16S擴增子測序分析比較了ND和HFD喂養的果蠅的腸道細菌組成,HFD顯著增加了革蘭氏陽性細菌,特別是乳桿菌屬(Lactobacillus)的豐度(Fig.3D)。喂養野生型(未敲除Tdc基因)的L. Brevis(短乳桿菌)或E. Faecalis(糞腸球菌)足以增加腸細胞中的cytoCa2+,而喂養敲除Tdc基因的L. Plantarum(植物乳桿菌)則未能增加(Fig.3E,F)。薄層色譜(TLC)分析顯示,L. Brevis和E. Faecalis培養基中的TA水平顯著增加,而L.Plantarum(植物乳桿菌)則沒有(Fig.3G)。使用TA合成的抑制劑煙酸(NA)可以降低TA水平,并且能夠顯著減少HFD或L. Brevis引起的腸細胞內cytoCa2+濃度的升高(Fig.3H)。這些結果表明,HFD條件下革蘭氏陽性細菌的增加是TA產生的來源,并且這些細菌產生的TA通過激活腸細胞中的Ca2+信號來發揮作用。
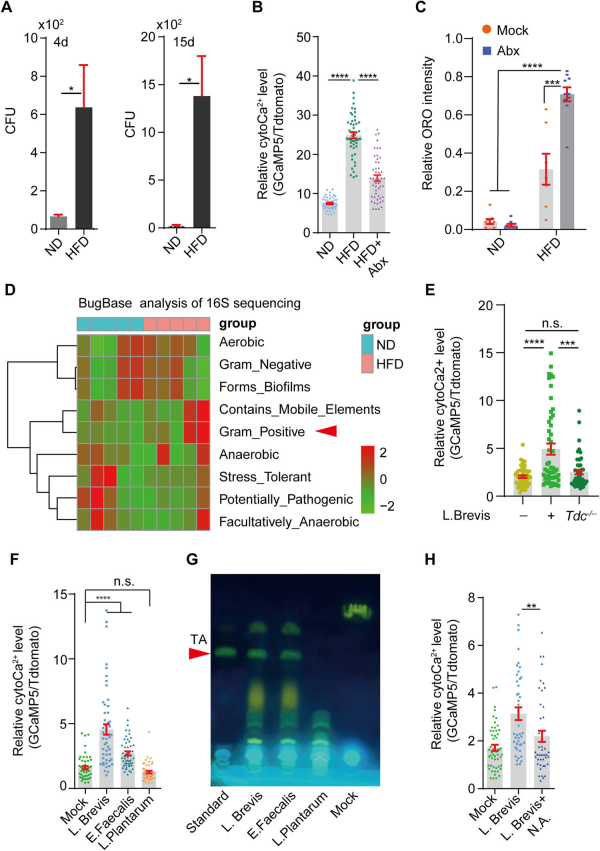
Fig3. 由HFD增加的革蘭氏陽性菌負責酪胺的產生
4.?由革蘭氏陽性菌產生的酪胺通過酪胺受體TyrR1激活腸內Ca2+信號通路
通過敲減Gαq或TyrR1,可以抑制酪胺(TA)或高脂飲食(HFD)介導的ECs內cytoCa2+升高(Fig.4A,B),進一步證實了敲低TyrR1足以阻斷TA誘導的cytoCa2+水平的增加(Fig.4C)。CREB是一種保守的轉錄因子,受cytoCa2+調控,參與控制多種生物學過程。通過免疫染色和熒光素酶報告基因分析顯示HFD喂養后腸細胞中CREB活性增加(Fig.4D,E),這一過程涉及鈣-鈣調蛋白激酶的磷酸化作用。敲降CaMKII或Gαq可以阻斷這種激活(Fig.4F,G),表明HFD通過TA/TyrR1/Gαq介導的鈣離子級聯反應激活CREB。通過p-CREB的免疫染色顯示了TA喂養、Serca敲低或L. Brevis喂養增加了腸細胞中的CREB活性(Fig.4H-J),Gαq的敲低抑制了HFD誘導的CREB激活(Fig.4K)。通過ORO染色顯示CREB突變體(CREBΔ36)在ND和HFD條件下都積累了更多的腸細胞內脂質,而過表達CRTC足以抑制HFD或GαqRNAi誘導的脂質積累(Fig.4L-N)。這些結果表明,通過TyrR1受體激活的cytoCa2+信號級聯反應在調節腸細胞的脂質代謝中起著核心作用。
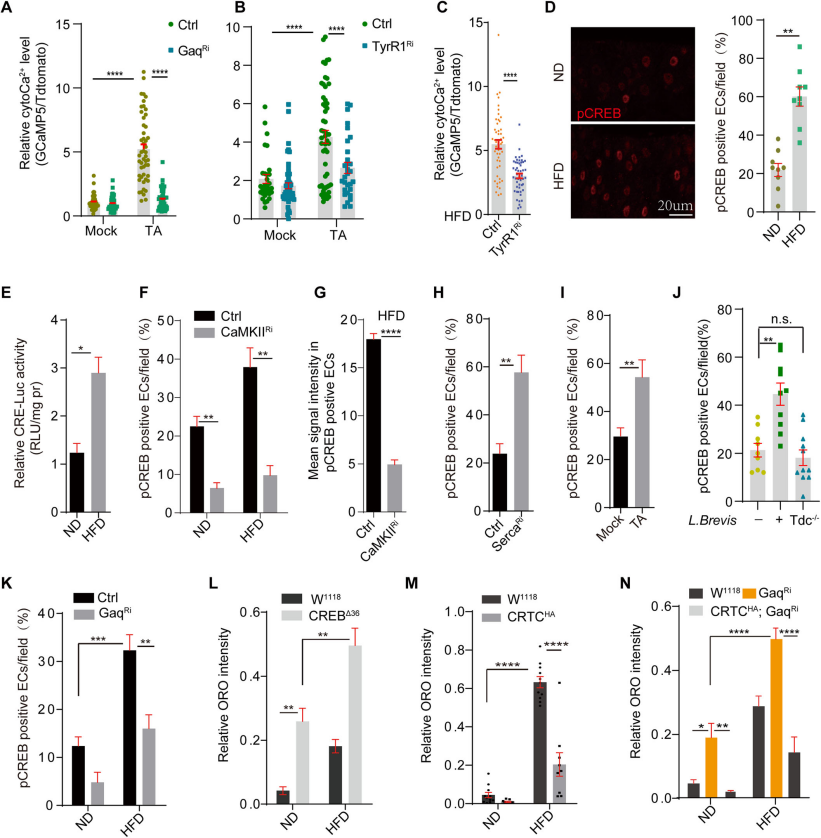
Fig4.革蘭氏陽性菌產生的酪胺通過酪胺受體tyrR1激活腸道Ca2+信號
5.?Ca2+/CRTC/CREB級聯抑制了Magro的表達,從而抑制了膳食脂質消化
通過RNA-seq測序分析找到CRTCOE和IP3ROE在腸道中共同調控的基因(Fig.5A),RT- PCR驗證了腸道中magro基因表達的確實顯著降低(Fig.5B,C)。生物信息學分析發現magro啟動子區域含有兩個保守的CRE基序,并通過ChIP-qPCR分析證實CREB可以直接結合magro基因的啟動子(Fig.5D)。抑制magro基因表達后腸道脂質的減少(Fig.5E),通過糞便樣本的脂質水平和腸道腔中的脂肪酶活性測定,進一步證實了CRTC過表達抑制了飲食脂質的消化(Fig.5F,G),添加胰蛋白酶可以部分恢復CRTC過表達誘導的腸道中性脂質的減少(Fig.5H)。這些結果表明,Ca2+/CRTC/CREB信號通路通過抑制飲食脂質消化的關鍵酶Magro的表達來調節腸道脂質水平。
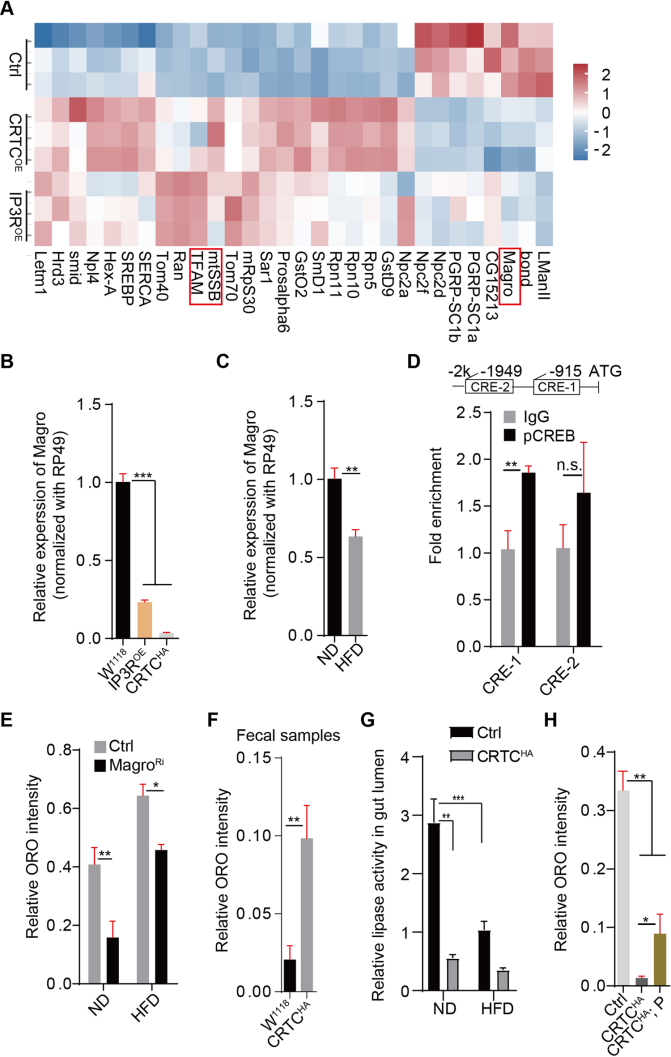
Fig5. Ca2+/CRTC/CREB級聯抑制了magro的表達,從而抑制了膳食脂質消化
6.?Ca2+/CRTC/CREB級聯促進線粒體生物發生并抑制腸細胞脂肪生成
通過qRT-PCR分析了腸道中基因表達的變化,顯示了CRTC過表達能顯著下調DGATs基因(CG1942和CG1946,參與脂肪生成的關鍵基因) (Fig.6A)。通過qPCR和WB分析證實了CRTC過表達增加了ctDNA(線粒體DNA)拷貝數和線粒體質量(Fig.6B,C)。通過BODIPY-C12熒光標記的脂肪酸追蹤實驗,觀察了在CRTC過表達或TA喂養條件下,脂肪酸在腸細胞和腹部脂肪細胞中的分布變化(Fig.6D-F)。定量分析了腸細胞中BODIPY-C12與LipidTOX(中性脂質染料)雙陽性斑點的數量,表明脂肪酸在腸細胞中的局部消耗增加(Fig.6G-H)。通過TAG檢測試劑盒分析了脂肪體中的TAG水平,顯示CRTC過表達降低了TAG水平(Fig.6I)。綜上所述,這些結果表明ECs中的cytoCa2+抑制膳食脂質消化和腸內脂肪生成,同時促進線粒體生物生成?(Fig.6J)。
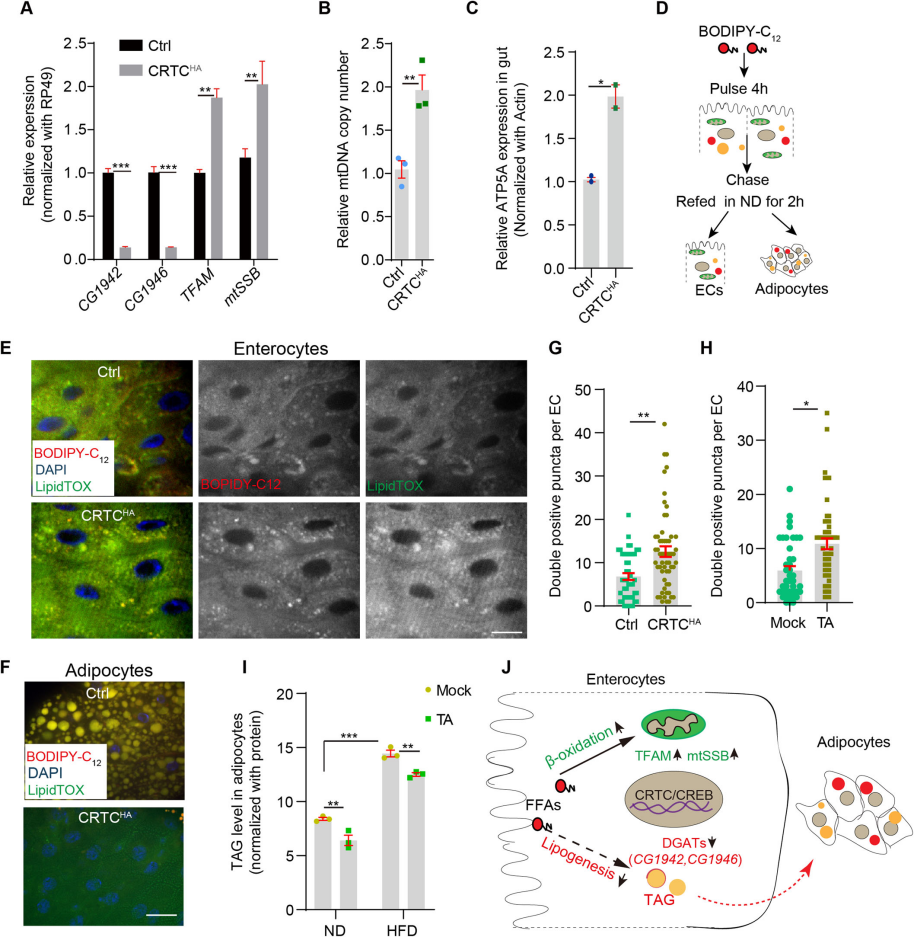
Fig6. Ca2+/CRTC/CREB級聯促進線粒體生物發生并抑制腸細胞脂肪生成
7.?TA介導的Ca2+信號級聯抑制HFD介導的胰島素抵抗
通過Akt-SPARK報告基因檢測了胰島素刺激下ECs中Akt活性的變化,顯示HFD喂養的小鼠腸細胞中Akt活性降低,而補充TA或過表達CRTC能夠恢復這種活性(Fig.7A,B),同時,TA補充或CRTC過表達也能顯著恢復HFD喂養果蠅的腸細胞中的胰島素敏感性(Fig.7C),進一步實驗證實了這些處理能夠抑制HFD引起的系統性高脂血癥(Fig.7D)。這些結果表明,HFD喂養引起腸道胰島素抵抗,腸道Ca2+介導的CRTC/CREB活性的進一步升高足以緩解糖尿病表型(Fig.7E)。
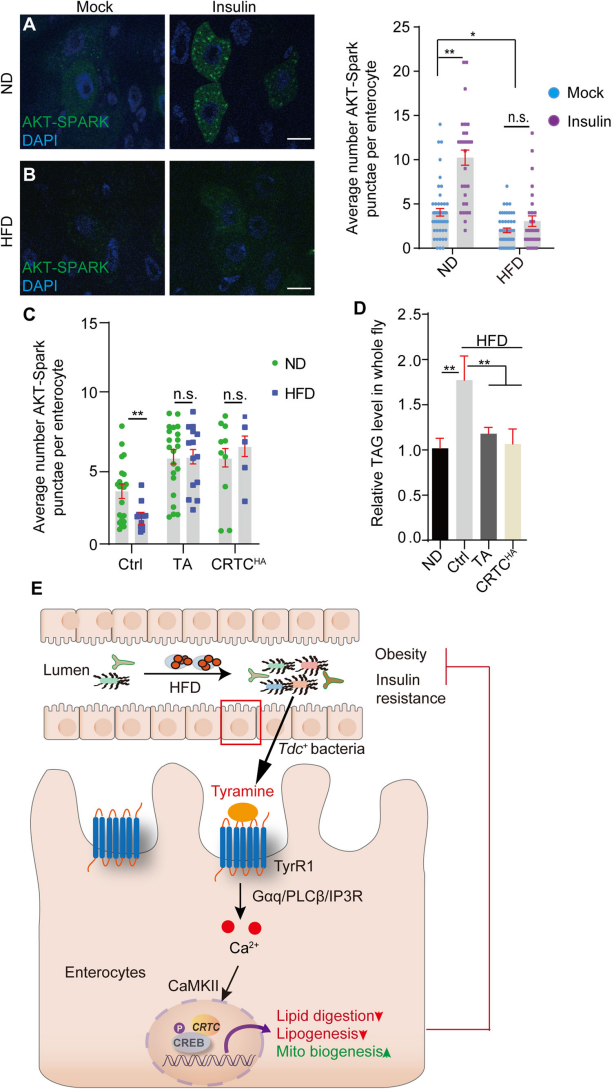
Fig7. TA介導的Ca2+信號級聯抑制HFD介導的胰島素抵抗
總? 結
本文通過在果蠅和小鼠模型上的研究發現,高脂飲食引起的腸道菌群失調導致酪胺(TA)的產生增加,TA通過激活腸細胞中的cytoCa2+信號通路,進而激活CRTC-CREB轉錄復合體,這種信號級聯不僅抑制了飲食脂質的消化和腸道脂肪生成,還促進了線粒體生物發生,最終減輕了HFD誘導的胰島素抵抗。此外,研究還發現,TA的攝入能夠改善小鼠的葡萄糖耐受性和胰島素敏感性,表明TA可能成為治療HFD相關代謝性疾病的潛在靶點。這些發現揭示了腸道微生物代謝產物與宿主代謝之間的復雜相互作用,并為開發新的代謝疾病治療策略提供了科學依據。




地圖數據)


)

學習總結)


——深度Q學習)

在3GPP系統中的增強支持(十四)-無人機操控關鍵績效指標(KPI)框架)

:優化性能并為應用程序添加狀態)
策略模式)

)
)