歡迎關注我的CSDN:https://spike.blog.csdn.net/
本文地址:https://spike.blog.csdn.net/article/details/136302202

大分子藥物設計領域主要包括3個方面,即大環類藥物設計、蛋白質與多肽類藥物設計、核酸藥物設計等,具體如下:
-
大環類藥物設計:是指利用具有大環結構的化合物作為藥物候選分子或先導化合物的設計策略。大環結構可以提高藥物的親和力、滲透性、穩定性和選擇性,同時可以作用于難以成藥的靶點,如蛋白-蛋白相互作用。大環類藥物的設計需要考慮大環的形成、尺寸、構象和元素組成等因素,以及與靶點的結合模式和動力學。大環類藥物的合成也是一個挑戰,需要選擇合適的關環反應和條件。
-
蛋白質與多肽類藥物設計:是指利用具有蛋白質或多肽結構的生物大分子作為藥物候選分子或先導化合物的設計策略。蛋白質與多肽類藥物具有高度的特異性和生物活性,可以模擬或調節生理過程中的信號分子,如激素、生長因子、抗體等。蛋白質與多肽類藥物的設計需要考慮蛋白質或多肽的序列、結構、穩定性、可溶性、半衰期和免疫原性等因素,以及與靶點的結合模式和動力學。蛋白質與多肽類藥物的合成可以采用化學或生物技術的方法,如固相合成、酶催化、基因工程等。
-
核酸藥物設計:是指利用具有核酸結構的生物大分子作為藥物候選分子或先導化合物的設計策略。核酸藥物可以通過與靶標RNA或DNA進行雜交或結合,從而調控基因的表達或編輯。核酸藥物的種類包括寡核苷酸藥物(如siRNA、miRNA、antisense oligo等)和核糖核酸藥物(如mRNA、CRISPR RNA等)。核酸藥物的設計需要考慮核酸的序列、結構、穩定性、遞送系統和毒性等因素,以及與靶標的結合模式和動力學。核酸藥物的合成可以采用化學或生物技術的方法,如固相合成、酶催化、轉錄等。
1. 大環類藥物設計
大環類藥物是指分子中含有至少一個大于12個原子的環的化合物,具有一些特殊的理化和生物學性質,例如:
- 可以提高藥物與靶標的親和力和選擇性,因為大環結構可以限制分子的構象自由度,減少熵損失,增強分子間的相互作用。
- 可以改善藥物的滲透性和穩定性,因為大環結構可以根據環境的極性調整自身極性,掩埋和屏蔽部分極性基團,降低極性表面積,從而適應不同的生物屏障。同時,大環結構也可以抵抗酶的水解和代謝,延長藥物的體內半衰期。
- 可以作用于難以成藥的靶標,如蛋白-蛋白相互作用,因為大環結構可以模擬天然的肽或蛋白片段,與靶標蛋白的大型結合口袋相匹配,突破Lipinski規則的限制。
大環類藥物在藥物設計中的應用場景很廣泛,包括抗感染、抗癌、免疫調節、神經系統等領域。已經上市或正在臨床試驗的大環藥物的例子有:
- 奧波佐米(Oprozomib),口服的大環類藥物,用于治療多發性骨髓瘤,蛋白酶體抑制劑,可以阻斷惡性細胞的蛋白降解途徑,誘導細胞凋亡,目前處于Ⅱ期臨床試驗。
- 奧馬西汀(Omadacycline),靜脈或口服的大環類藥物,用于治療社區獲得性肺炎和皮膚感染,四環素類抗生素,可以抑制細菌的蛋白質合成,具有廣譜的抗菌活性,已經于2018年獲得美國FDA的批準。
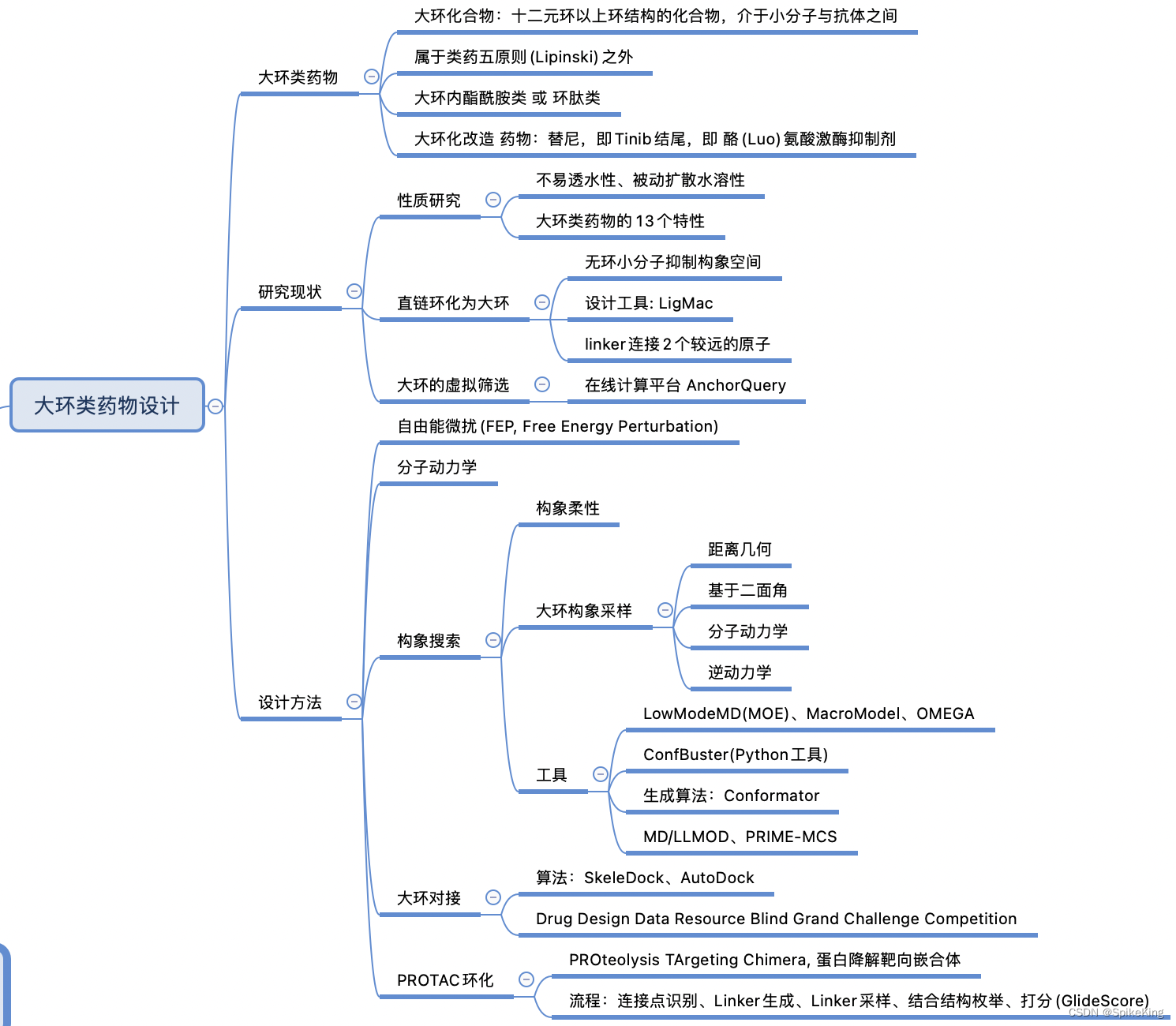
替尼類藥物,即Tinib結尾,即Tyrosine Kinase Inhibitons,酪(Luo)氨酸激酶抑制劑。酪氨酸激酶抑制劑是一類能抑制酪氨酸激酶活性的化合物,已經開發為數種抗腫瘤藥物。酪氨酸激酶抑制劑主要通過抑制細胞信號轉導而抑制腫瘤細胞的生長和增殖,促進細胞凋亡。
2. 蛋白質與多肽類藥物設計
蛋白質與多肽類藥物設計的要點主要包括以下幾個方面:
- 目標選擇:根據疾病的機理和靶點的特性,選擇合適的蛋白質或多肽作為藥物候選物。
- 多肽合成:通過化學或生物技術的方法,合成所需的蛋白質或多肽分子,或者對其進行修飾以改善其穩定性、溶解性、半衰期等性質。
- 藥物篩選:通過體外和體內的實驗,評估藥物的活性、選擇性、毒性、藥代動力學等參數,篩選出最優的藥物候選物。
- 藥物優化:通過結構優化、劑型優化、給藥途徑優化等手段,提高藥物的效果、安全性、便利性等指標,使其符合臨床要求。
蛋白質與多肽類藥物設計的應用場景非常廣泛,目前已有超過80種蛋白質與多肽類藥物上市,涵蓋了內分泌、免疫、神經、腫瘤等多個領域。例如:
- 胰島素:一種用于治療糖尿病的多肽藥物,可以降低血糖水平,模擬人體內的胰島素功能。
- 赫賽汀:一種用于治療HER2陽性乳腺癌的單克隆抗體藥物,可以與HER2受體結合,阻斷其信號傳導,抑制腫瘤細胞的增殖和存活。
- 骨形成蛋白:一種用于治療骨質疏松癥的蛋白質藥物,可以刺激骨前體細胞的分化,促進骨組織的形成和修復。

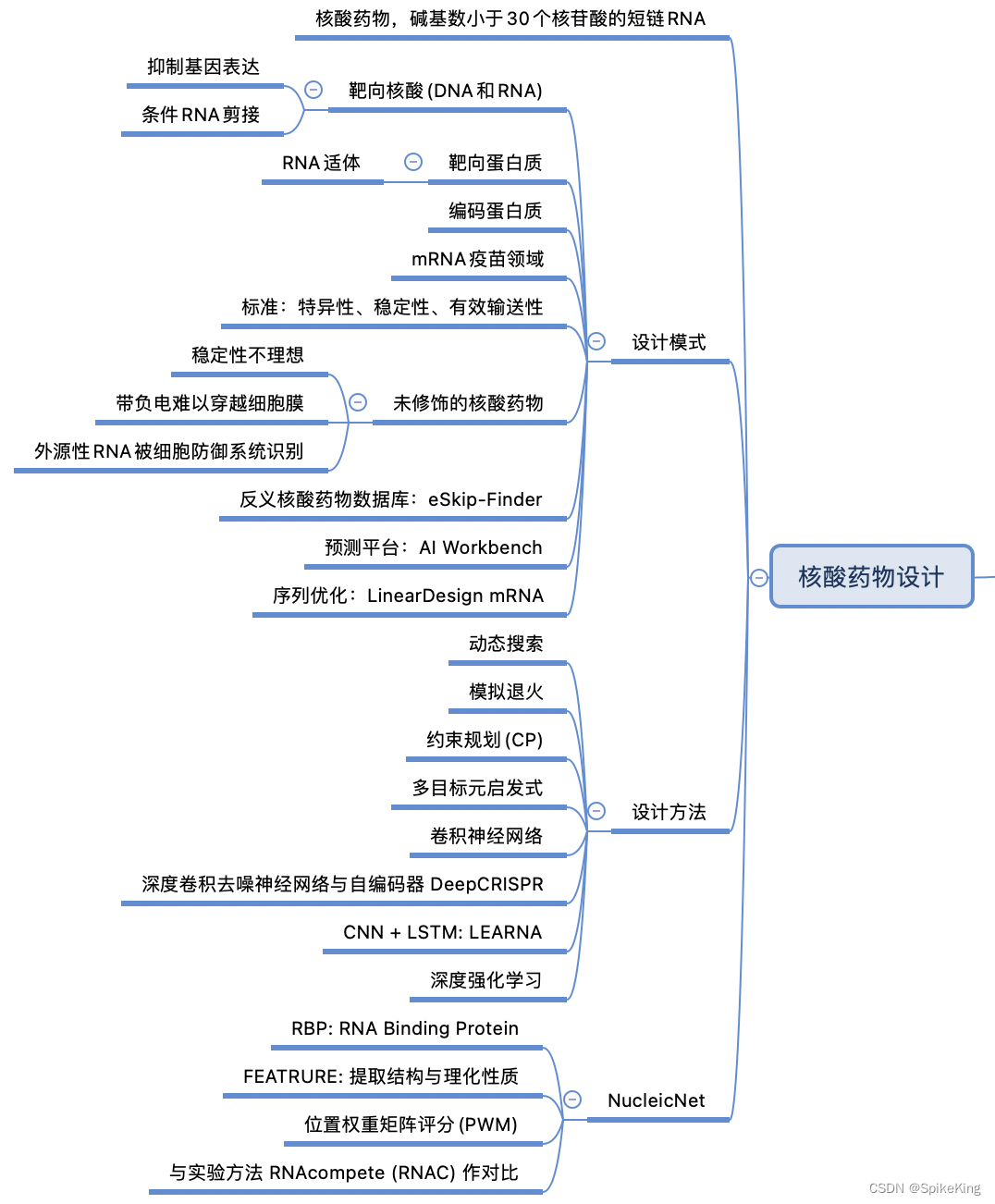
3. 核酸藥物設計
核酸藥物是一類利用核酸分子作為藥物或藥物載體的新型藥物,可以通過調節基因表達來治療各種疾病。核酸藥物的主要分類有:
- 反義核酸(Antisense Oligonucleotides, ASO):與靶基因的mRNA互補的單鏈核酸分子,可以通過雜交、降解或阻斷mRNA的翻譯來抑制基因的表達。
- 小干擾RNA(Small Interfering RNA, siRNA):由兩條互補的單鏈 RNA 組成的雙鏈RNA分子,可以通過RNA干擾(RNA interference, RNAi)機制,引導 RISC 復合物切割與之互補的mRNA,從而降低基因的表達。
- 信使RNA(Messenger RNA, mRNA):是一種攜帶遺傳信息的單鏈RNA分子,可以通過轉錄后修飾和包裹技術,被送入細胞內,作為蛋白質的模板進行翻譯,從而增加基因的表達。
核酸藥物具有高度的特異性、選擇性和效力,可以針對難以成藥的靶點和疾病,具有廣闊的應用前景。
核酸藥物設計是一種利用核酸分子(如DNA或RNA)作為藥物的策略,通過與疾病相關的基因或蛋白質相互作用,調節其表達或功能,從而達到治療或預防的目的。核酸藥物設計的要點包括:
- 核酸藥物的選擇:根據藥物的作用機制和靶點,選擇合適的核酸分子類型,如siRNA、miRNA、antisense oligo、mRNA、CRISPR RNA等。
- 核酸藥物的設計:根據核酸藥物的特性和需求,進行序列優化、化學修飾、結構設計等,提高藥物的穩定性、親和力、特異性、效率和安全性。
- 核酸藥物的遞送:根據核酸藥物的目標組織和細胞,選擇合適的遞送系統,如脂質體、納米粒子、病毒載體等,增強藥物的生物利用度、細胞內轉運和釋放。
核酸藥物設計的應用場景非常廣泛,理論上,任何由基因異常引起的疾病都可以通過核酸藥物進行治療或預防,如癌癥、遺傳性疾病、感染性疾病、代謝性疾病等。目前,已有多種核酸藥物進入臨床試驗或上市,如Nusinersen(治療脊髓性肌萎縮癥)、Patisiran(治療遺傳性淀粉樣變性)、Moderna的mRNA疫苗(預防新冠病毒感染)等。核酸藥物設計是藥物研發領域的一個重要方向,具有巨大的潛力和前景。




)












單容器管理)
)
